

| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
| A、将40 g NaOH溶解于1 L水中配成的NaOH溶液 | ||
| B、常温常压下,将22.4 L HCl 气体溶于水配成1 L的盐酸溶液 | ||
C、将1 L 0.5 mol?L-1的浓盐酸加热浓缩为
| ||
| D、从1000 mL 1 mol?L-1 NaCl溶液中取出100 mL的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可逆反应的特征是正反应速率等于逆反应速率 |
| B、在其他条件不改变时,增大压强对溶液间反应几乎无影响 |
| C、温度升高,可以使可逆反应正反应速率加快,但逆反应速率可以不变 |
| D、化学反应的限度是不可改变的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
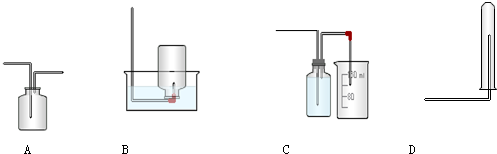
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
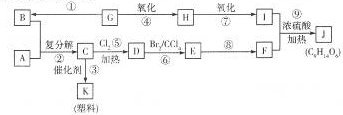
 CH2=CH2+R1CH=CHR2
CH2=CH2+R1CH=CHR2查看答案和解析>>
科目:高中化学 来源: 题型:
| O3/Zn+H2O |

 反应是否进行完全,设计一个简单实验加以证明并写出实验操作、现象及结论:
反应是否进行完全,设计一个简单实验加以证明并写出实验操作、现象及结论:查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实验内容 | 实验目的 |
| A | 将含有HCl杂质的CO2通入饱和Na2CO3溶液中 | 除去CO2中的HCl |
| B | 将含氯化铁杂质的氯化铵如中加入氢氧化钠溶液,过滤 | 除去氯化铵中的氯化铁 |
| C | 向FeCl2溶液中加入铁粉 | 除去FeCl2溶液中的FeCl3 |
| D | 向NaHCO3溶液中加入Ca(OH)2溶液 | 除去NaHCO3溶液中的Na2CO3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com