
【题目】将下列物质的水溶液在蒸发皿中蒸干后充分灼烧,最终能得到该溶质固体的是
A.FeCl3B.K2CO3C.Na2SO3D.NaHCO3
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】氮氧化物是大气污染物之一,消除氮氧化物的方法有多种。
Ⅰ催化还原法
(1)利用甲烷催化还原氮氧化物。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160 kJ/mol
则CH4将NO2还原为N2的热化学方程式为____________________________。
(2)利用NH3催化还原氮氧化物(SCR技术)。该技术是目前应用最广泛的烟气氮氧化物脱除技术。反应的化学方程式为:2NH3(g)+NO(g)+NO2(g)![]() 2N2(g)+3H2O(g) ΔH < 0。为提高氮氧化物的转化率可采取的措施是_______________(写出1条即可)。
2N2(g)+3H2O(g) ΔH < 0。为提高氮氧化物的转化率可采取的措施是_______________(写出1条即可)。
(3)在汽车排气管内安装的催化转化器,可使尾气中主要污染物转化为无毒物质。主要反应如下:2NO(g)+ 2CO(g)![]() N2(g)+ 2CO2(g)。在一定温度下,向体积为1L的密闭容器中通入2molNO、1molCO,发生上述反应,10分钟时反应达到平衡状态,此时容器中CO变为0.6molL-1。
N2(g)+ 2CO2(g)。在一定温度下,向体积为1L的密闭容器中通入2molNO、1molCO,发生上述反应,10分钟时反应达到平衡状态,此时容器中CO变为0.6molL-1。
①前10分钟内用氮气表示的反应速率为___________,计算该温度下反应的平衡常数K为______Lmol-1。(只列算式,不要求计算结果)
②若保持温度不变,在15分钟时向容器内再次充入NO 1.6 mol、CO2 0.4 mol,则此时反应的ν正___ν逆(填“<”、“=”或“> ”)
II 氧化法。
(4)首先利用ClO2 氧化氮氧化物,再利用还原剂还原为无毒的氮气。其转化流程如下:
NO![]() NO2
NO2![]() N2。
N2。
已知反应Ⅰ的化学方程式为2NO+ ClO2 + H2O =NO2 + HNO3 + HCl,则反应Ⅱ的化学方程式是_____________________________;若生成11.2 L N2(标准状况),则消耗ClO2____________g 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述正确的是( )
A. 氧化铁是一种碱性氧化物,常用作红色油漆和涂料
B. 在医疗上碳酸钠、氢氧化铝均可用于治疗胃酸过多
C. Na2O2与水反应,红热的Fe与水蒸气反应均能生成碱
D. 人造刚玉熔点很高,可用作高级耐火材料,主要成分是SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL浓H2SO4溶液(足量)中加入3.2g Cu,在加热条件下充分反应:
(1)反应消耗的H2SO4的物质的量是 , 生成SO2的体积为(标准状况下)mL.
(2)若题干中浓硫酸的物质的量浓度为a molL﹣1 , 投入足量的铜片加热,充分反应后,被还原的硫酸的物质的量n(H2SO4)0.025a mol(填“等于”、“大于”或“小于”).
(3)将题干中反应后的溶液稀释到500mL,取出50mL,并向取出液中加入足量的BaCl2溶液,得到沉淀19.81g,求原浓硫酸的物质的量浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当密闭容器中合成氨反应N2+3H2![]() 2NH3达到平衡后,保持温度不变,将容器的容积压缩为原来的1/2。达到新平衡后,与原平衡相比较,下列说法中正确的是
2NH3达到平衡后,保持温度不变,将容器的容积压缩为原来的1/2。达到新平衡后,与原平衡相比较,下列说法中正确的是
A. 容器内的总压强为原来的2倍 B. N2的浓度比原来平衡浓度小
C. H2的转化率为原来的2倍 D. 气体的密度为原来的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】强酸与强碱的稀溶液发生中和反应热效应表示为:H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3KJmol﹣1分别向1L0.5molL﹣1的Ba(OH)2的溶液中加入①浓硫酸;②稀硝酸;③稀醋酸,恰好完全反应的热效应分别为△H1、△H2、△H3,下列关系正确的是()
A.△H1>△H2>△H3B.△H1<△H2<△H3
C.△H1>△H2=△H3D.△H1=△H2<△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在400℃、101 kPa时,NO2(g) +CO(g) ![]() NO(g) + CO2(g) 反应过程的能量变化如下图所示。
NO(g) + CO2(g) 反应过程的能量变化如下图所示。
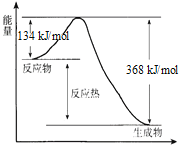
反应过程
(1)该反应是_____________(填“吸热”或“放热”)反应。
(2)该反应的热化学方程式为_____________。
(3)改变下列条件都可使该反应的反应速率改变,其中通过降低活化能加快反应速率的是_____________。
a.浓度 b.压强 c.温度 d.催化剂
(4)反应体系中加入催化剂对反应热是否有影响?____(填“是”或“否”),原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钴是制作氧化钴和金属钴的原料,一种利用含钴废料(主要成分为Co2O3,含少量Fe2O3、ZnO、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如下:
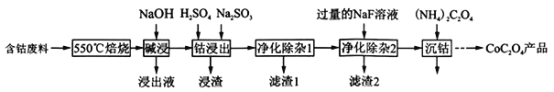
已知:ZnO与Al2O3化学性质相似,既能溶于强酸又能溶于强碱
(1)“550℃焙烧”的目的是______________________;
(2)“浸出液”的主要成分是_____________________;
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为_____________________;
(4) “净化除杂1”过程中,先在40 ~ 50℃加入H2O2,其作用是____________________ (用离子方程式表示);再升温至80~85℃,加入___________溶液,调pH至4.5以达到净化除杂的目的。
(5)“净化除杂2”过程中,若溶液c(Ca2+)=0.01mol/L,使Mg2+恰好沉淀完全即溶液中c(Mg2+)=1.0×10-5mol/L,此时是否有CaF2沉淀生成________________?(列式计算)[已知Ksp(MgF2) =7.0×10-11、Ksp(CaF2) =1.0×10-10]。
(6)为测定制得样品的纯度,现称取1.000g样品,将其用适当试剂转化,得到草酸铵[(NH4)2C2O4]溶液,再用过量稀硫酸酸化,用0. 1000 mol/L KMnO4溶液滴定,达到滴定终点时,共用去KMnO4溶液26.00 mL,则草酸钴样品的纯度为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各说法中,正确的是
A. 对于2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-Q kJ·mol-1,(Q>0),若反应中充入1mol SO2和足量的氧气反应时,放出的热量一定是Q/2 kJ
2SO3(g) ΔH=-Q kJ·mol-1,(Q>0),若反应中充入1mol SO2和足量的氧气反应时,放出的热量一定是Q/2 kJ
B. 热化学方程式中的化学计量数不能用分数表示
C. Zn(s)+H2SO4(aq) ===ZnSO4(aq)+H2(g) ΔH<0,该反应的化学能可以转化为电能
D. ΔH的大小与热化学方程式的化学计量数无关
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com