
| 实验编号 | 0.01mol•L-1酸性KMnO4溶液 | 0.1mol•L-1H2C2O4溶液 | 水 | 1mol•L-1MnSO4溶液 | 反应温度/℃ | 反应时间 |
| Ⅰ | 2mL | 2mL | 0 | 0 | 20 | 125 |
| Ⅱ | 2mL | 1mL | 1mL | 0 | 20 | 320 |
| Ⅲ | 2mL | 2mL | mL | 0 | 50 | 30 |
| Ⅳ | 2mL | 2mL | 0 | 2滴 | 20 | 10 |
分析 (1)溶液混合后显示紫红色,当紫红色褪去后计时结束;
(2)实验I和II研究浓度对反应速率的影响;实验I和III研究温度对反应速率的影响;
(3)MnSO4溶液为催化剂;
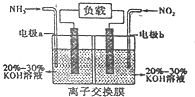
(4)由反应6NO2+8NH3═7N2+12H2O可知,反应中NO2为氧化剂,NH3为还原剂,则A为负极,B为正极,负极发生氧化反应,正极发生还原反应,结合电解质溶液呈碱性解答.
解答 解:(1)实验计时方法是从溶液混合开始记时,到紫红色刚好褪去计时结束,故答案为:紫红色刚好褪去;
(2)根据实验目的,选择合理数据:高锰酸钾作为指示剂,浓度不变,都是2mL;实验I和II研究浓度对反应速率的影响,草酸体积为1mL;实验I和III研究温度对反应速率的影响,浓度全部相同,
故答案为:
| II | 2 | 1 | |
III | 2 | 2 | 0 |
点评 本题考查影响化学反应速率的因素、电极反应式书写、电解池反应原理等,需要认真分析题中信息,得出合理结论,本题难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 加水稀释后,溶液中c(H+)减小 | |
| B. | 加入少量NaOH固体,电离度增大,溶液的pH增大 | |
| C. | 加入少量NH4Cl固体,氨水电离平衡向右移动 | |
| D. | 通入少量HCl气体后,电离平衡常数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 目的 | A.实验室制取并收集O2 | B.检验装置气密性 | C.制取蒸馏水 | D.分离水和四氯化碳 |
| 装置或操作 | 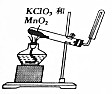 | 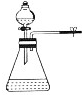 | 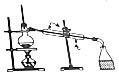 |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 酸碱中和反应是中学化学一类重要的反应,某学生实验小组对课本中的两个酸碱中和实验进行了研究.
酸碱中和反应是中学化学一类重要的反应,某学生实验小组对课本中的两个酸碱中和实验进行了研究.| 实验次数 | 起始滴定管读数 | 终点滴定管读数 |
| 1 | 0.00mL | 24.02mL |
| 2 | 0.50mL | 24.46mL |
| 3 | 2.50mL | 25.02mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KCl中含有35Cl | |
| B. | 生成物Cl2的平均相对分子质量为73.3 | |
| C. | 1molK35ClO3参加反应,失去电子数为5NA | |
| D. | 氧化剂和还原剂的物质的量之比1:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
实验 混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO4(mL) | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液(mL) | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O(mL) | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
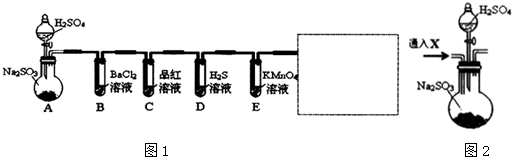
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
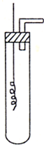 某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如下图所示的实验装置.请你根据他们的思路,选择下列药品完成实验,填写实验步骤并回答问题.供选择的药品:铜丝、稀硝酸、烧碱溶液、铁粉、CaCO3颗粒.
某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如下图所示的实验装置.请你根据他们的思路,选择下列药品完成实验,填写实验步骤并回答问题.供选择的药品:铜丝、稀硝酸、烧碱溶液、铁粉、CaCO3颗粒.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
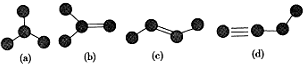
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com