
分析 先判断晶体类型,再判断化学键类型;
①BaCl2属离子晶体,只含离子键;
②金刚石属原子晶体,只含共价键;
③碘片属分子晶体,含共价键,分子间存在分子间作用力;
④冰属分子晶体,含共价键,分子间存在分子间作用力;
⑤Na2SO4属于离子晶体,存在离子键和共价键.
解答 解:①BaCl2属离子晶体,只含离子键;
②金刚石属原子晶体,只含共价键;
③碘片属分子晶体,含共价键,分子间存在分子间作用力;
④冰属分子晶体,含共价键,分子间存在分子间作用力;
⑤Na2SO4属于离子晶体,存在离子键和共价键.
(1)熔化时不需要破坏化学键的是分子晶体,熔化时需要破坏共价键的是原子晶体.
故答案为:③④; ②.
(2)只有离子键的物质是①,含有共价键的离子化合物是⑤;
故答案为:①; ⑤.
点评 本题考查的知识点较多,侧重考查学生对离子键、共价键,离子化合物、共价化合物的书写的辨别能力,题目难度不大.


科目:高中化学 来源: 题型:解答题
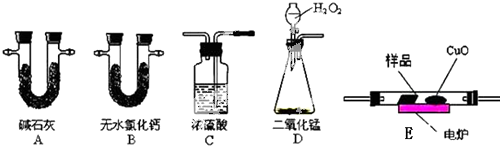
 取4.4g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重8.8g,B管增重3.6g.请回答:
取4.4g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重8.8g,B管增重3.6g.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将28.8g铜投入100ml浓硝酸中,最后铜剩余,其NO3-离子物质的量变化如图所示,请回答下列问题:
将28.8g铜投入100ml浓硝酸中,最后铜剩余,其NO3-离子物质的量变化如图所示,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成40.0 L N2(标准状况) | |
| B. | 有0.250 mol KN03被氧化 | |
| C. | 转移电子的物质的量为1.25 mol | |
| D. | 被氧化的N原子的物质的量为2.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2与D2 | B. | T2O与H2O | ||
| C. | ${\;}_{19}^{40}$K与${\;}_{19}^{39}$K | D. | 金刚石与石墨 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
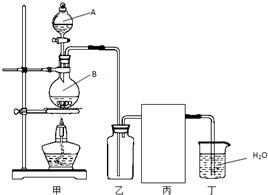 (1)实验室制备HCl气体的反应为:
(1)实验室制备HCl气体的反应为:| 实验 次数 | 草酸溶液的体积 (mL) | ||
| 1 | 20.00 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16O与18O互为同位素;H2${\;}_{\;}^{16}$O、D2${\;}_{\;}^{16}$O、H2${\;}_{\;}^{18}$O、D2${\;}_{\;}^{18}$O互为同素异形体 | |
| B. | SiH4、PH3、HCl的稳定性逐渐增强 | |
| C. | 氧化铁的化学式:FeO | |
| D. | Ca2+的结构示意图为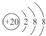 ,NH4Cl的电子式为 ,NH4Cl的电子式为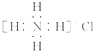 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其它 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浮选法富集方铅矿的过程属于化学变化 | |
| B. | 方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO | |
| C. | 将1molPbS冶炼成Pb理论上至少需要6g碳 | |
| D. | 整个冶炼过程中,制取1molPb共转移2mol电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com