
| ||
| 高温高压 |
| ||
| 高温高压 |
| n-x |
| (n-x)+(n-3x)+2x |
| m |
| n |


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
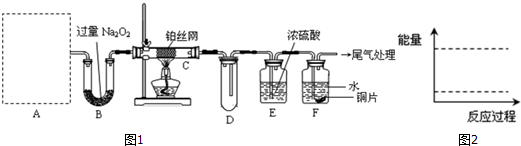
| 2 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 .有机物X的键线式为:
.有机物X的键线式为: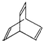
查看答案和解析>>
科目:高中化学 来源: 题型:
| 多步氧化 |
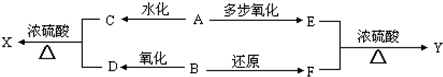
| n |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| R | ||
| X | Y | Z |
| A、X的氢化物比Z的氢化物稳定 |
| B、原子半径大小顺序是Z>Y>X |
| C、Y、R形成的化合物YR3能使酸性KMnO4溶液褪色 |
| D、X、Z可形成化合物XZ3,分子中各原子均满足最外层8电子的稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲醇、甲醛 |
| B、苯、1,3-丁二烯 |
| C、丙烯、2-丁烯 |
| D、乙醇、乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com