
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源:2015-2016学年黑龙江哈尔滨六中高二上期中测试化学试卷(解析版) 题型:选择题
分析下列反应在任何温度下均能自发进行的是
A.2N2(g)+O2(g)= 2N2O(g) ΔH=+163 kJ·mol-1
B.Ag(s)+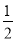 Cl2(g)= AgCl(s) ΔH=-127 kJ·mol-1
Cl2(g)= AgCl(s) ΔH=-127 kJ·mol-1
C.HgO(s)= Hg(l)+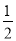 O2(g) ΔH=+91 kJ·mol-1
O2(g) ΔH=+91 kJ·mol-1
D.H2O2(l)= 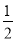 O2(g)+H2O(l) ΔH=-98 kJ·mol-1
O2(g)+H2O(l) ΔH=-98 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三上学期期中测试化学试卷(解析版) 题型:选择题
下列关于胶体的叙述不正确的是
A.胶体区别于其他分散系的本质特征是分散质的微粒直径在1 nm~100 nm之间
B.用平行光照射CuSO4溶液和Fe(OH)3胶体,可以加以区分
C.把FeCl3饱和溶液滴入到NaOH溶液中,以制取Fe(OH)3胶体
D.树林中的晨曦,该现象与丁达尔效应有关
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省四地六校高二上学期10月一次联考化学试卷(解析版) 题型:选择题
一种碳纳米管能够吸附氢气,用这种材料吸氢后制备的二次电池(充放电电池)工作原理如下图所示,该电池的电解质为6 mol·L-1KOH溶液,下列说法中正确的是

A.放电时K+移向碳电极
B.放电时电池负极的电极反应为H2-2e-= 2H+
C.充电时镍电极的电极反应为Ni(OH)2 + OH――e-= NiO(OH) + H2O
D.该电池充电时将碳电极与电源的正极相连,发生氧化反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省四地六校高一上学期10月一次联考化学试卷(解析版) 题型:选择题
下列各组物质按纯净物、混合物、电解质、非电解质的顺序排列的是:
A、纯碱、氯水、氢氧化钠、干冰
B、醋酸、盐酸、铜、氨气
C、石灰石、石油、水、硫酸钡
D、烧碱、海水、氯化钠、氯气
查看答案和解析>>
科目:高中化学 来源:2015-2016学年贵州省乌当区新天学校高二上学期期中测试化学试卷(解析版) 题型:?????
下列说法正确的是
A.化学键的变化必然会引起能量变化,所以,能量变化也一定会引起化学变化
B.所有化学变化的能量都可以通过原电池转化为电能
C.所有化学变化一定遵循质量守恒和能量守恒
D.凡是需要加热的反应都是吸热反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省华士、成化、山观三校高二上期中必修化学试卷(解析版) 题型:填空题
2011年12月13日,加拿大正式宣布将退出《京都议定书》,这使CO2的排放问题再次成为了热点。当空气中CO2的体积分数超过0.050%时,会引起明显的温室效应。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
I.最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,在一定条件下与H2反应,使之变为可再生燃料甲醇。其流程如下:
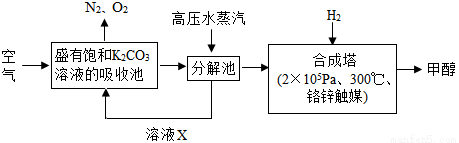
①上述流程中碳酸钾溶液所起的作用是 。
②在分解池中发生的反应为 (写出化学方程式)。
Ⅱ.碳酸钾是重要的无机化工、医药、轻工原料之一,主要用于医药、玻璃、染料等工业, 可用作气体吸附剂,干粉灭火剂,橡胶防老剂等。
已知:CO2、碳酸盐、碳酸氢盐的部分性质如下:
CO2(过量)+OH-=HCO3- HCO3-+OH-=CO32-+H2O
CO32-与H+反应生成CO2分两步:
CO32-+H+=HCO3-;HCO3-+H+=H2O+CO2↑
①小王同学在实验室用如图所示的装置和药品制取K2CO3溶液。
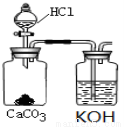
他所制得的溶液中可能含有的杂质是 。
②该同学在数字实验室中用传感器对碳酸钾和碳酸氢钾的混合物样品进行成分测定,他分别称取三份不同质量的混合物样品,配成稀溶液,然后分别逐滴加入相同浓度的50 ml硫酸,测得如下数据:
实验编号 1 2 3
混合物的质量/g 3.76 4.70 8.46
硫酸溶液的体积/mL 50.00 50.00 50.00
生成二氧化碳的物质的量/mol 0.03 0.0375 0.03
试计算:该混合固体中K2CO3与KHCO3的物质的量之比是 所用硫酸的物质的量浓度为 mol•L-1。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西八一、洪都、麻丘中学等高二上期中联考化学试卷(解析版) 题型:填空题
已知2A(g)+B(g) 2C(g) ΔH=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加2 mol A和1 mol B,在500 ℃时充分反应达平衡后C的浓度为ω mol/L,放出热量为b kJ。
2C(g) ΔH=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加2 mol A和1 mol B,在500 ℃时充分反应达平衡后C的浓度为ω mol/L,放出热量为b kJ。
(1)比较a b(填“>”“=”或“<”)。
(2)下表为不同温度下该反应的平衡常数。由此可推知,表中T1 T2(填“>”“=”或“<”)。
T/K | T1 | T2 | T3 |
K | 1.00×107 | 2.45×105 | 1.88×103 |
若在原来的容器中,只加入2 mol C,500 ℃时充分反应达平衡后, 吸收热量为c kJ,C的浓度 (填“>”“=”或“<”)ω mol/L,a、b、c之间满足何种关系 (用代数式表示)。
(3)在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是
A.4 mol A和2 mol B B.4 mol A、2 mol B和2 mol C
C.4 mol A和4 mol B D.6 mol A和4 mol B
(4)将上述容器改为恒压容器(反应前体积相同),起始时加入2 mol A和1 mol B,500 ℃时充分反应达平衡后,放出热量为d kJ,则d b(填“>”“=”或“<”)
(5)一定温度下,向一个容积可变的容器中,通入3 mol A和2 mol B及固体催化剂,使反应,平衡时容器内气体物质的量为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4 mol A、3 mol B和2 mol C,则平衡时A的百分含量 (填“不变”“变大”“变小”或“无法确定”)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省四地六校高二上学期11月联考化学试卷(解析版) 题型:选择题
用CaCO3与1 mol·L-1稀盐酸反应制取CO2,下列措施对反应速率几乎没影响的是
A.改用浓度为0.5 mol·L-1的稀硫酸
B.加入更多的碳酸钙
C.稍微加热,升高反应温度
D.改用浓度为2 mol·L-1的稀盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com