
【题目】有机化合物J是治疗心脏病药物的一种中间体,分子结构中含有3个六元环。其中一种合成路线如下:
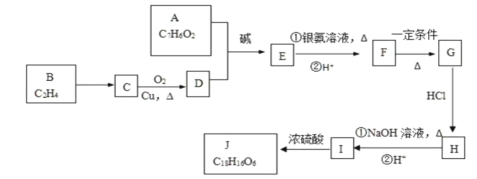
已知:
①有关A的信息如下:
能发生银镜反应 |
与FeCl3溶液发生显色反应 |
核磁共振氢谱显示有4组峰,峰面积之比为1:2:2:1 |
②R1-CHO+R2-CH2-CHO![]()
![]()
回答以下问题:
(1)A中含有的含氧官能团名称是________和________。
(2)写出反应类型:G→H:________、I→J:________。
(3)写出下列过程化学方程式。
①F→G的化学方程式__________________。
②B→C的化学方程式__________________。
(4)写出J的结构简式___________。
(5)结合题给信息,以D为原料经过三步反应制备1,3丁二烯,设计合成路线_________(其他试剂任选)。合成路线流程图示例:CH3CH2Cl![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3
CH3COOCH2CH3
【答案】醛基 羟基 加成反应 酯化反应或取代反应 ![]()
![]()
![]() +H2O CH2=CH2+H2O
+H2O CH2=CH2+H2O![]() CH3CH2OH
CH3CH2OH 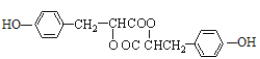
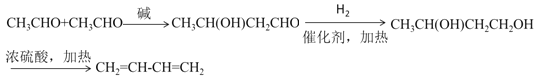
【解析】
A能发生银镜反应,说明含有醛基,又能与FeCl3溶液发生显色反应,说明含有酚羟基,其核磁共振氢谱显示有4种氢,且峰面积之比为1:2:2:1,结合A的分子式可知,A的结构简式为![]() ;由C转化为D的条件,A、D发生信息②中的反应得到D,可知C为醇,故分子式是C2H4的B结构简式是CH2=CH2,B与水发生加成反应生成C为CH3CH2OH,C催化氧化产生D为CH3CHO、E为
;由C转化为D的条件,A、D发生信息②中的反应得到D,可知C为醇,故分子式是C2H4的B结构简式是CH2=CH2,B与水发生加成反应生成C为CH3CH2OH,C催化氧化产生D为CH3CHO、E为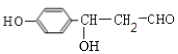 ;E发生氧化反应生成F为
;E发生氧化反应生成F为![]() ,由G→H→I的条件,H应发生卤代烃的水解反应,可推知F在浓硫酸作用下发生消去反应生成G为
,由G→H→I的条件,H应发生卤代烃的水解反应,可推知F在浓硫酸作用下发生消去反应生成G为![]() ,根据J的分子中含有3个六元环,可知G与氯化氢发生加成反应,氯原子加在羧基邻位碳上,生成H为
,根据J的分子中含有3个六元环,可知G与氯化氢发生加成反应,氯原子加在羧基邻位碳上,生成H为![]() ,H在碱性条件下发生水解生成I为
,H在碱性条件下发生水解生成I为 ,两分子I在浓硫酸作用下发生成酯化反应,生成环酯J为
,两分子I在浓硫酸作用下发生成酯化反应,生成环酯J为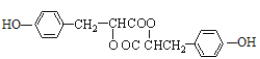 ;
;
(5)乙醛先在碱性条件下得到CH3CH(OH)CH2CHO,再与氢气发生加成反应得到CH3CH(OH)CH2CH2OH,最后发生消去反应得到1,3-丁二烯。
根据上述分析可知:A是![]() ;B是CH2=CH2,C为CH3CH2OH,D为CH3CHO;E为
;B是CH2=CH2,C为CH3CH2OH,D为CH3CHO;E为 ;F为
;F为![]() ,G为
,G为![]() ,H为
,H为![]() ,I为
,I为![]() ,J为
,J为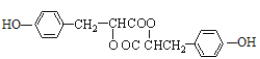 。
。
(1)A的结构简式为![]() ,A中含有的含氧官能团名称是醛基、羟基;
,A中含有的含氧官能团名称是醛基、羟基;
(2)G为![]() ,G与HCl在一定条件下发生加成反应产生H为
,G与HCl在一定条件下发生加成反应产生H为![]() ,故G→H的反应属于加成反应;
,故G→H的反应属于加成反应;
I为![]() ,分子中含有羟基、羧基,2个分子的I发生酯化反应产生J为
,分子中含有羟基、羧基,2个分子的I发生酯化反应产生J为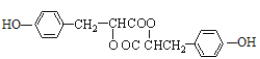 和水,所以I→J是酯化反应,酯化反应也属于取代反应;
和水,所以I→J是酯化反应,酯化反应也属于取代反应;
(3)①F为![]() ,F与浓硫酸混合加热发生消去反应产生G:
,F与浓硫酸混合加热发生消去反应产生G:![]() 和水,反应方程式为:
和水,反应方程式为:![]()
![]()
![]() +H2O;
+H2O;
②B是CH2=CH2,C为CH3CH2OH,乙烯与H2O在一定条件下发生加成反应产生乙醇,故B→C的化学方程式为:CH2=CH2+H2O![]() CH3CH2OH;
CH3CH2OH;
(4)根据上述分析可知J的结构简式为: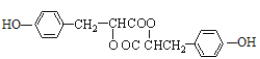 ;
;
(5)乙醛先在碱性条件下得到CH3CH(OH)CH2CHO,再与氢气发生加成反应得到CH3CH(OH)CH2CH2OH,最后发生消去反应得到1,3-丁二烯,故以乙醛为原料合成路线流程图为: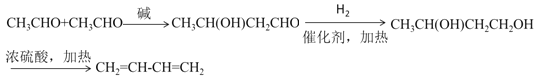 。
。


科目:高中化学 来源: 题型:
【题目】实验测得,某有机物相对分子质量为72。
(1)若该有机物是烃,其分子式为__________。它有______种同分异构体。若该烃与![]() 发生取代反应,生成的一氯代物只有1种,则该烃的结构简式为___________________。
发生取代反应,生成的一氯代物只有1种,则该烃的结构简式为___________________。
(2)若该有机物分子中只有一个氧原子,其分子式为_____________________。
(3)若该有机物![]() 完全燃烧生成0.15molCO2和0.1molH2O,则该有机物的分子式为___________。
完全燃烧生成0.15molCO2和0.1molH2O,则该有机物的分子式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Cu(NO3)2的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): ;实验室在配制 AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈 性,原因是(用离子方程式表示): 。把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(3)在配制氯化铁溶液时,为了防止发生水解,可以加入少量的 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示

下列说法正确的悬
A. △H1<0,△H2>0
B. 反应①②③的反应热满足关系:△H2-△H1=△H3
C. 反应①②③的平衡常数满足关系;K1·K2=K3
D. 要使反应③在一定条件下建立的平衡向正反应方向移动,可采取升温措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2L甲醛气体与xL的氧气混合点燃,反应后甲醛和氧气均无剩余,生成的混合气体的体积为aL(气体体积均在120°C,101kPa时测定),并将此aL混合气体通过足量的碱石灰后,测得剩余气体的体积为bL。若a-b=3.5,则x的值为
A. 2B. 4C. 1.75D. 3.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼[(CH3)2N—NH2]与N2O4是常用的火箭推进剂,火箭发射时常出现红棕色气体,发生的化学反应如下:
① (CH3)2N—NH2(l) + 2N2O4(l) = 2CO2(g) + 3N2(g) + 4H2O(g) H1<0
② N2O4(l) ![]() 2NO2(g) H2 >0
2NO2(g) H2 >0
下列说法不正确的是
A.反应①中,N2O4为氧化剂
B.反应①中,生成1mol CO2时,转移8 mol e-
C.由反应②推断:加压、降温是获得液态N2O4的条件
D.温度升高,反应①的化学反应速率减小、反应②的化学反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室进行二氧化硫制备与性质实验的组合装置(如图),部分固定装置未画出。
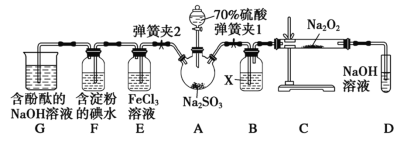
(1)在组装好装置后,若要检验A~D装置的气密性,其操作是___,再往D中装水,然后微热A,观察到D中有气泡冒出,移开酒精灯,D中导气管中有水柱形成且高度保持不变,说明装置气密性良好。
(2)装置B中试剂X是___,它的作用是___。
(3)关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体,检验SO2与Na2O2反应是否有氧气生成的操作及现象是___。
(4)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F、G中,能说明I-还原性弱于SO2的现象为___,发生反应的离子方程式是___。
(5)E中溶液由棕黄色变为浅绿色,写出发生反应的离子方程式。___
(6)G中含酚酞的NaOH溶液逐渐褪色,欲证明褪色的原因是SO2具有漂白性还是SO2溶于水显酸性。请设计实验___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素。下列判断正确的是
![]()
A.甲一定是金属元素
B.气态氢化物的稳定性:庚>己>戊
C.乙、丙、丁的最高价氧化物的水化物可以相互反应
D.庚的最高价氧化物的水化物酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)元素是人体必需的微量元素之一。下列说法正确的是
A.硒的摄入量越多对人体健康越好B.SeO32-空间构型为正四面体
C.H2Se的熔沸点比H2S高D.H2SeO4的酸性比H2SO4强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com