下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃).
| 电解质 |
平衡方程式 |
平衡常数K |
Ksp |
| CH3COOH |
CH3COOH?CH3COO-+H+ |
1.76×10-5 |
|
| H2CO3 |
H2CO3?H++HCO3-
HCO3-?H++CO32- |
K1=4.31×10-7
K2=5.61×10-11 |
|
| C6H5OH |
C6H5OH?C6H5O-+H+ |
1.1×10-10 |
|
| H3PO4 |
H3PO4?H++H2PO4-
H2PO4-?H++HPO42-
HPO42-?H++PO43- |
K1=7.52×10-3
K2=6.23×10-8
K3=2.20×10-13 |
|
| H3BO3 |
|
5.7×10-10 |
|
| NH3?H2O |
NH3?H2O?NH4++OH- |
1.76×10-5 |
|
| H2O |
|
Kw=1.0×10-14 |
|
| Mg(OH)2 |
Mg(OH)2?Mg2++2OH- |
|
5.6×10-12 |
回答下列问题:
I.(1)由上表分析,若①CH
3COOH ②HCO
3- ③C
6H
5OH ④H
2PO
4-均可看作酸,则它们酸性由强到弱的顺序为
(须填编号);
(2)写出C
6H
5OH与Na
3PO
4反应的离子方程式:
;
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH
3COO
-)
c(NH
4+);(填“>”、“=”或“<”)
(4)25℃时,向10mL 0.01mol/L苯酚溶液中滴加VmL 0.01mol/L氨水,混合溶液中粒子浓度关系正确的是
;
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c(NH
4+)>c(C
6H
5O
-)>c(H
+)>c(OH
-)
C.V=10时,混合液中水的电离程度大于10mL 0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH
3?H
2O)+2c(NH
4+)=c(C
6H
5O
-)+c(C
6H
5OH)
(5)如图1所示,有T
1、T
2两种温度下两条BaSO
4在水中的沉淀溶解平衡曲线,回答下列问题:
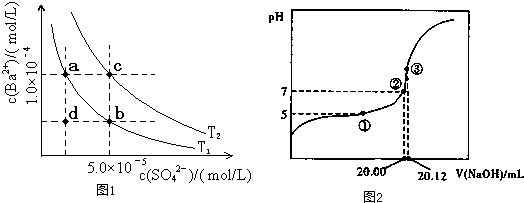
①T
1
T
2(填>、=、<);
②讨论T
1温度时BaSO
4的沉淀溶解平衡曲线,下列说法正确的是
.
A.加入Na
2SO
4可使溶液由a点变为b点
B.在T
1曲线上方区域(不含曲线)任意一点时,均有BaSO
4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
II.平衡常数的计算:
(1)用0.1000mol?L
-1NaOH溶液滴定20.00mL某未知浓度的醋酸溶液,滴定曲线图2.其中①点所示溶液中c(CH
3COO
-)=2c(CH
3COOH)、③点所示溶液中存在:c(CH
3COO
-)+c(CH
3COOH)=c(Na
+)则CH
3COOH的电离平衡常数Ka=
.
(2)水解反应是典型的可逆反应.水解反应的化学平衡常数称为水解常数(用Kh表示),类比化学平衡常数的定义,请写出Na
2CO
3第一步水解反应的水解常数的表达式:Kh=
.
(3)MgCl
2溶液和氨水混合后存在下列化学平衡:Mg
2+(aq)+2NH
3?H
2O(aq)?2NH
4+(aq)+Mg(OH)
2(s)试列出该反应平衡常数K与Kb(NH
3?H
2O)、Ksp[Mg(OH)
2]的关系式并计算:
.



