
【题目】二氧化氯(ClO2)是易溶于水且不与水反应的黄绿色气体,沸点为11℃。某小组在实验室中制备ClO2的装置如下:[已知:SO2+2NaClO3+H2SO4=2ClO2 +2NaHSO4]
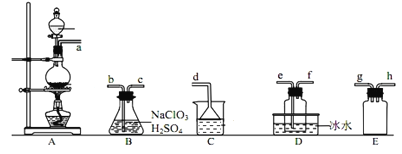
下列说法正确的是
A.装置C中装的是饱和食盐水,a逸出的气体为SO2
B.连接装置时,导管口a应接h或g,导管口c应接e
C.装置D放冰水的目的是液化SO2,防止污染环境
D.可选用装置A利用1mol·L1盐酸与MnO2反应制备Cl2
【答案】B
【解析】
利用A装置制取SO2,在B中发生制取反应得到ClO2,ClO2的沸点为11℃,利用冰水浴冷凝,可在装置D中收集到ClO2;E为安全瓶,防B中的液体进入到A中,E放置在A与B之间。C为尾气吸收装置,吸收多余的SO2。
A、利用A装置制取SO2,a逸出的气体为SO2,C为尾气吸收装置,用于吸收多余的SO2,应该装有NaOH溶液,A错误;
B、利用A装置制取SO2,在B中发生制取反应得到ClO2,E为安全瓶,防B中的液体进入到A中,E放置在A与B之间,所以a应接h或g;装置D中收集到ClO2,导管口c应接e,B正确;
C、ClO2的沸点11℃,被冰水浴冷凝,在D中收集到,C错误;
D、MnO2有浓盐酸反应,1mol·L-1并不是浓盐酸,D错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:下列判断正确的是( )
实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
A.实验①反应后的溶液中:c(A﹣)>c(K+)>c(OH﹣)>c(H+)
B.实验①反应后的溶液中:c(OH﹣)=c(K+)﹣c(A﹣)=![]() mol/L
mol/L
C.实验②反应后的溶液中:c(A﹣)+c(HA)<0.1 mol/L
D.实验②反应后的溶液中:c(K+)+c(OH﹣)=c(H+)+c(A﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是发展中的新能源,它的利用包括氢的制备.储存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是_________(至少答出两点)。但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:____________。
(2)氢气可用于制备H2O2。已知: H2(g)+A(l)=B(l)ΔH1 O2(g)+B(l)=A(l)+H2O2(l)ΔH2 ,其中A.B为有机物,两反应均为自发反应,则H2(g)+ O2(g)= H2O2(l)的ΔH________0(填“>”.“<”或“=”)。
(3)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g) ![]() MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
a.容器内气体压强保持不变 b.吸收ymol H2只需1 mol MHx
c.若降温,该反应的平衡常数增大 d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(4)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为_________。
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。

①电解一段时间后,c(OH)降低的区域在_______(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.向血红色的Fe(SCN)3溶液中加入少量KI 固体,溶液颜色变浅
B.氨水溶液加水稀释,c(OH-)增大,平衡常数增大
C.pH=12的NaOH和Na2S溶液中水的电离程度前者大于后者
D.25℃,Cu(OH)2在水中的溶度积和溶解度比其在Cu(NO3)2溶液中的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如下图。下列关于分枝酸的叙述正确的是( )
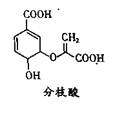
A.分子中含有3种官能团
B.1mol分枝酸最多可与3mol NaOH发生中和反应
C.可与乙醇、乙酸反应,且反应类型相同
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消除含氮、硫等化合物的污染对建设美丽家乡,打造宜居环境具有重要意义。
I.用NH3催化还原NOx可以消除氮氧化物的污染,NOx若以NO为例,在恒容容器中进行反应:4NH3(g)+6NO(g) ![]() 5N2(g)+6H2O(g) ΔH<0。
5N2(g)+6H2O(g) ΔH<0。
(1)以下选项可以判断反应达到平衡状态的是_______。
A..4v正(NH3)=5v逆(N2) B.反应体系中气体密度不变
C..反应体系中气体压强不变 D.反应体系中气体平均摩尔质量不变
(2)图I中曲线表示转化率与反应时间的关系。若改变起始条件,使反应过程由a状态转为b状态进行,可采取的措施是_______

A.降低温度 B.增大反应物中NO的浓度
C.加催化剂 D.向密闭容器中通入氩气
II.燃煤烟气中含有大量SO2和NO。某科研小组研究臭氧氧化的碱吸收法同时脱除SO2和NO工艺,反应进程如图II所示。
反应1:NO(g)+O3(g)![]() NO2(g)+O2(g)
NO2(g)+O2(g)
反应2:SO2(g)+O3(g)![]() SO3(g)+O2(g)
SO3(g)+O2(g)

已知该体系中温度80℃以上臭氧发生分解反应:2O3![]() 3O2。且100℃时臭氧的分解率约为10%。请回答:
3O2。且100℃时臭氧的分解率约为10%。请回答:
(1)写出反应1的热化学方程式_______,反应1在高温下不能自发进行,则该反应的熵变ΔS_______0(填“大于”或“小于”)。
(2)其他条件不变,向五个体积固定为1L的密闭容器中均充入含1.0 mol NO、1.0 mol SO2的模拟烟气和2.0mol O3,在不同温度下反应相同时间后体系中NO和SO2的转化率如图所示:

①若P、Q两点为非平衡点,试分析P点转化率大于Q点的可能原因_______。100℃,t秒时反应1进行到P点,反应从开始到t秒时NO的平均速率v(NO)=_______mol·L1·s1(用含t的式子表示)。
②若Q点为平衡点,100℃下反应2的平衡常数的数值约为_______(精确到0.01)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是( )
A. HCO3-在水溶液中的电离方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. H2SO3的电离方程式H2SO3![]() 2H++SO32-
2H++SO32-
C. CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. CaCO3的电离方程式:CaCO3 ![]() Ca2++CO32-
Ca2++CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn(s,白)+2HCl(aq)=SnCl2(aq)+H2(g) △H1
②Sn(s,灰)+2HCl(aq)=SnCl2(aq)+H2(g) △H2
③Sn(s,灰)![]() Sn(s,白) △H3=+2.1kJmol-1
Sn(s,白) △H3=+2.1kJmol-1
下列说法正确的是( )
A.△H1>△H2
B.锡在常温下以灰锡状态存在
C.灰锡转为白锡的反应是放热反应
D.锡制器皿长期处在低于13.2℃的环境中,会自行毁坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒容密闭容器中通入一定量CH4和NO2发生反应:CH4(g)+4NO2(g)4NO(g)+CO2(g)+2H2O(g) ΔH,测得在相同时间、不同温度下NO2的转化率如图:

下列叙述正确的是( )
A.ΔH>0
B.由图像可知:200℃时NO2的平衡转化率小于300℃时NO2的平衡转化率
C.c、d两点转化率相等,这两点均处于平衡状态
D.若延长温度维持在300℃的反应时间,则转化率将大于42%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com