
在体积都为1L,pH都等于2的盐酸和醋酸溶液中,投入0.65g锌粒,则下图所示比较符合客观事实的是
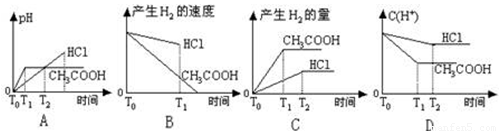
C
【解析】
试题分析:0.65g锌的物质的量=0.65g÷65g/mol=0.01mol,需要盐酸和醋酸的物质的量都是0.02mol。盐酸是强酸,醋酸是弱酸,在pH都是2的情况下盐酸的浓度是0.01mol/L,而醋酸的浓度大于0.01mol/L。溶液的体积都是1L,因此盐酸的物质的量是0.01mol,醋酸的物质的量大于0.01mol。所以与0.65g锌反应时盐酸不足,醋酸过量,即醋酸产生的氢气多。在反应过程中醋酸还可以继续电离出氢离子,所以醋酸的反应速率快,因此C正确。A、起始时溶液的pH=2,而不是0,A不正确;B、产生氢气的速率醋酸快,B不正确;D、在反应过程中醋酸溶液中氢离子浓度大于盐酸溶液中氢离子浓度,D不正确,答案选C。
考点:考查盐酸、醋酸与锌的反应的有关判断、计算以及图像分析


科目:高中化学 来源:2013届黑龙江省高二上学期期末考试化学试卷 题型:选择题
在体积都为1L、pH都等于2的盐酸和醋酸溶液中,投入0.65g锌粒,则下列各图所示内容比较符合客观事实的是

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com