

(1)写出:A的化学式__________ ,F的化学式____________ 。
(2)在反应①~⑦中,不属于氧化还原反应的是 ___________(填序号)。
(3)完成:E和X反应的离子方程式:________________ ;
(4)完成H和某种化合物快速制C的化学方程式_________ ,每生成0.15molC电子转移 _________mol。
(5)B蒸气与过量氨气混合有白烟及另一种气体单质产生,该反应的化学方程式为:___________ 。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:


| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
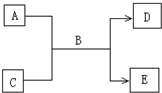 (2009?南充模拟)A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系:
(2009?南充模拟)A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系:查看答案和解析>>
科目:高中化学 来源: 题型:
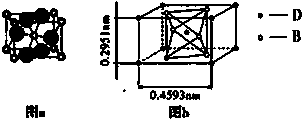
查看答案和解析>>
科目:高中化学 来源: 题型:
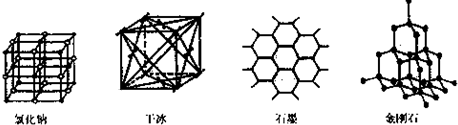
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省嘉兴市高三上学期基础测试化学试卷(解析版) 题型:填空题
已知A、B、C、D是中学化学的常见物质,它们在一定条件下有如下转
化关系:
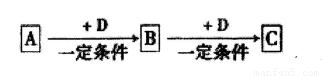
(1)若A为能使湿润的红色石蕊试纸变蓝的气体,C为红棕色气体。则A的空间构型为 ,A转化为B反应的化学方程式为 。
(2)若A、B、C均为氧化物,A为砖红色固体,且A中金属元素为+1价,D是一种黑色固态非金属单质,则A的化学式为 ,B的电子式为 。
(3)若D为氯碱工业的主要产品,B为高中常见的一种具有两性的物质,则C溶液中除氢氧根外还存在的阴离子的化学式为 。氯碱工业中阴极的电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com