
| [OH-] |
| [NH3?H2O] |
| [OH-] |
| [NH3?H2O] |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 原子序数 | 电子排布式 | 在周期表中的位置 | 最高价氧化物的水化物化学式及酸碱性 | 气态氢化物的化学式 |
| 14 | ||||
| 1s22s22p63s23p5 | ||||
| 第二周期第VA主族 |
查看答案和解析>>
科目:高中化学 来源: 题型:
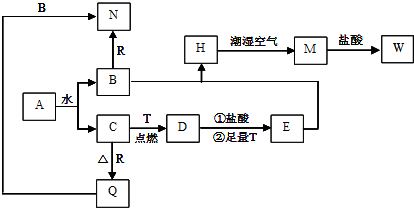
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、单位时间内生成3n molA2,同时消耗2n molAB |
| B、容器内,3种气体AB、A2、B2共存 |
| C、AB的消耗速率等于A2的消耗速率 |
| D、容器中各组分的物质的量分数不随时间变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、H+、SO32-、HClO |
| B、Al3+、Mg2+、OH-、CO32- |
| C、K+、OH-、Cl-、NH3?H2O |
| D、Ba2+、Fe3+、NO3-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com