
【题目】三氯化铁是中学化学实验室中常用的化学试剂.同学们利用废铁屑(含少量铜杂质)来探究制备FeCl36H2O的方法,同学甲设计的实验装置如图所示,其实验步骤如下:A中放有废铁屑,烧杯中盛有足量的稀硝酸,实验时先打开a并关闭b,用分液漏斗向A中加入过量的盐酸充分反应,此时溶液呈浅绿色;再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使剩余HNO3分解,再降温结晶得FeCl36H2O晶体. 填写下列空白:
(1)滴加盐酸时,发现反应速率较之盐酸与纯铁粉反应要快,其原因是 .
(2)烧杯内放过量稀HNO3的原因是(用离子方程式表示).
(3)整个实验过程中,弹簧夹a都必须打开,除为排出产生的气体外,另一个目的是 .
(4)乙同学对该实验进行了改进,他是用空烧杯盛接滤液,加入适当的试剂,然后在HC1的气流中、一定温度下蒸发、浓缩、降温结晶而得到纯净的FeCl36H2O,你认为加入的试剂可以是 . (填序号) ①适量氯气 ②适量过氧化氢和稀盐酸
③酸性高锰酸钾溶液 ④氢氧化钠溶液.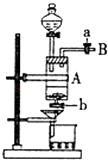
【答案】
(1)废铁屑中的不溶性杂质与Fe在盐酸中构成原电池,加快了反应速率
(2)3Fe2++4H++NO3﹣═3Fe3++NO↑+2H2O
(3)使装置内部与外界大气相通,便于A中液体流下
(4)①②
【解析】解:实验的目的是制备FeCl36H2O,由装置图可知,在A中,废铁屑与盐酸反应生成氯化亚铁,经过滤可分离出铜,氯化亚铁和过量的盐酸流入烧杯中,硝酸将氯化亚铁氧化生成氯化铁,经蒸发浓缩反应液,蒸发掉部分水并使剩余HNO3分解,再降温结晶得FeCl36H2O晶体,(1)废铁屑(含少量铜杂质)加盐酸后,Cu与铁形成Fe﹣Cu原电池使反应速率加快, 所以答案是:废铁屑中的不溶性杂质与Fe在盐酸中构成原电池,加快了反应速率;(2)过量的稀HNO3保证使Fe2+ 全部氧化成Fe3+;反应的离子方程式是:3Fe2++4H++NO3﹣═3Fe3++NO↑+2H2O,
所以答案是:3Fe2++4H++NO3﹣═3Fe3++NO↑+2H2O;(3)整个实验过程中,弹簧夹a都必须打开,则装置与大气相同,使分液漏斗中的酸可滴入A中,
所以答案是:使装置内部与外界大气相通,便于A中液体流下;(4)把氯化亚铁氧化为氯化铁,同时不能引入杂质,所以选用适量过氧化氢和稀盐酸,或用双氧水,
所以答案是:①②.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】室温下向10mL c(H+)=0.001 molL﹣1的醋酸溶液中加水稀释后,下对说法正确的是( )
A.溶液中导电粒子的数目减少
B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中 ![]() 不变
不变
D.再加入c(OH﹣)=0.001 mol?L﹣1的NaOH溶液,混合液的PH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.分子式为C7H16的烷烃,含有3个甲基的同分异构体有2种
B.丙烯能发生取代反应、加成反应,还能使酸性KMnO4溶液褪色
C.甲苯中所有原子都处于同一平面
D.相同质量的甲烷和乙烷完全燃烧乙烷耗氧量多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列实验所选择的装置或仪器不正确的是( )
A | B | C | D | |
实 验 | 实验分离水和酒精 | 用铵盐和碱制取氨气 | 用排空气法收集二氧化氮 | 用自来水制取蒸馏水 |
装置或仪器 |
|
|
|
|
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质间在一定条件下发生反应,主要为取代反应类型的是
A. 甲烷和氯气混合光照 B. 乙烯通入浓溴水中
C. 乙醛和氢气混合加催化剂后的反应 D. 乙烯在一定条件下变成聚乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)实验室中常用NaOH溶液来进行洗气和提纯,当100mL 3mol/L的NaOH溶液吸收标准状况下4.48L CO2时,所得溶液中各离子浓度由大到小的顺序为
(2)常温下向一定体积的0.1mol/L醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.醋酸的电离程度增大,c(H﹣)亦增大
C.溶液中 不变
D.溶液中 ![]() 减小
减小
(3)①常温下将0.15mol/L稀硫酸V1mL与0.1mol/L NaOH溶液V2 mL棍合,所得溶液的pH为1,则V1:V2=(溶液体积变化忽略不询.
②常温下若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得,则下列说法正确的是
A.若反应后溶液呈中性,则c(H+)+c(OH﹣)=2×10﹣7mol/L
B.若V1=V2 , 反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(4)常温下,浓度均为O.1mol/L的下列五种溶液的PH值如下表所示:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①根据表中数据,将浓度均为0.01mol/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是 .
A.CH3COOH+Na2CO3═NaHCO3+CH3COONa B.CH3COOH+NaCN═CH3COONa+HCN
C.CO2+H2O+2NaClO═Na2CO3+2HClO D.NaHCO3+HCN═NaCN+H2O+CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中化学键类型完全相同的是
A. HBr NaCl H2O B. H2O2 Na2O2 C2H4
C. NH3 H2O HC1 D. NaOH NH4C1 CaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.(该题中指的室温是20.C,Kw=1x10﹣14)请回答下列问题: 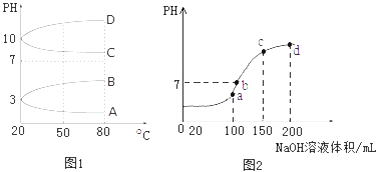
(1)相同条件下,相等物质的量浓度的NH4Al(SO4)2中c(NH4+)(填“=”、“>”“<”)NH4HSO4中c(NH4+).
(2)如图1是0.1molL﹣1电解质溶液的pH随温度变化的图象.
①其中符合0.1molL﹣1NH4Al(SO4)2的pH随温度变化的曲线是(填写字母);
②室温时,0.1molL﹣1NH4Al(SO4)2中2c(SO42﹣)﹣c(NH4+)﹣3c(Al3+)=molL﹣1(填数值)
(3)室温时,向100mL 0.1molL﹣1NH4HSO4溶液中滴加0.1molL﹣1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示.
试分析图中a、b、c、d四个点,水的电离程度最大的是;在b点,溶液中各离子浓度由大到小的排列顺序是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com