
【题目】合理应用和处理含氮的化合物,在生产生活中有重要意义。
(1)用活化后的V2O5作催化剂,氨气将NO还原成N2的一种反应历程如图1所示。

写出总反应化学方程式 。
(2)已知N2(g)+3H2(g)![]() 2NH3(g) △H=-94.4gKJ·mol-1,恒容时,体系中各物质浓度随时间变化的曲线如图2所示。
2NH3(g) △H=-94.4gKJ·mol-1,恒容时,体系中各物质浓度随时间变化的曲线如图2所示。

在2L容器中发生反应,前20min内,v(NH3)= ,放出的热量为 。
25min时采取的措施是 。
③时段III条件下,反应的平衡常数表达式为 (只列计算表达式,不计算)。
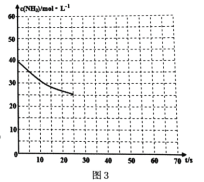
(3)用氨气制取尿素[CO(NH2)2]的反应:2NH3(g)+CO2(g) ![]() CO(NH2)2(s)+H2O(g);△H<0。某温度下,向容器为0.1L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的妆花率为50%。图3中的曲线表示在前25s内NH3的浓度随时间的变化而变化。其他条件不变,请在图3中用实线画出使用催化剂后c(NH3)随时间的变化曲线。
CO(NH2)2(s)+H2O(g);△H<0。某温度下,向容器为0.1L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的妆花率为50%。图3中的曲线表示在前25s内NH3的浓度随时间的变化而变化。其他条件不变,请在图3中用实线画出使用催化剂后c(NH3)随时间的变化曲线。
【答案】(12分)(1)4NH3+4NO+O2=4N2+6H2O
(2)①0.050molL-1min-1 (2分,无单位扣1分) 94.4kJ (2分)![]()
②将NH3从反应体系中分离出去(2分)③2.37
(3)
【解析】
试题分析:(1)用V2O5作催化剂,NH3可将NO还原成N2,结合反应历程图可知反应物还有氧气,生成物为N2和H2O,配平即得反应方程式为4NH3+4NO+O2![]() 4N2+6H2O;
4N2+6H2O;
(2)①根据图象可知,20min时氨气的物质的量浓度为1.00mol/L,所以氨气的平均反应速率为:v(NH3)=![]() =0.050mol(Lmin)-1;达到平衡时生成的氨气的物质的量为:1.00 mol/L×2L=2.00mol,根据N2(g)+3H2(g)2NH3(g);△H=-94.4kJmol-1可知生成2.00mol氨气放出的热量为94.4kJ;
=0.050mol(Lmin)-1;达到平衡时生成的氨气的物质的量为:1.00 mol/L×2L=2.00mol,根据N2(g)+3H2(g)2NH3(g);△H=-94.4kJmol-1可知生成2.00mol氨气放出的热量为94.4kJ;
②25min时氨气的物质的量迅速变为0而氮气、氢气的物质的量不变,之后氮气、氢气的物质的量逐渐减小,氨气的物质的量逐渐增大,说明25min时将NH3从反应体系中分离出去;
③时段Ⅲ条件下,该反应的化学平衡常数为:K=![]() ≈2.37;
≈2.37;
(4)若反应延续至70s,保持其它条件不变情况下,使用催化剂时,改变反应速率,不改变化学平衡,曲线的转折点在横坐标40之前,纵坐标必需在20的线上,该反应的进程曲线为如图所示: 。
。


科目:高中化学 来源: 题型:
【题目】某研究小组利用下图装置探究CO还原Fe2O3所得到的一种黑色粉末的成分(固定装置略去)。(已知:Fe2+遇到K3[Fe(CN)6]溶液生成蓝色沉淀)

请回答问題:
(1)按气流方向,各仪器接口从左到右的连接顺序为:
i→____________→____________→g→h→__________→__________→j → k→ ____________→___________。(填字母编号)
(2)证明Fe2O3己被还原的现象是___________________。
(3)研究小组对黑色粉末的成分提出下列猜想:
【猜想一】黑色粉末的成分可能是Fe。
【猜想二】黑色粉末的成分可能是FeO。
【猜想三】黑色粉末的成分可能是__________________。
设计并完成实验如下:
步骤 | 操作 | 现象 |
1 | 加入稀盐酸 | 溶解,无气泡 |
2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 |
3 | __________________ | 变红 |
①根据实验现象,则猜想_________成立。
②研究小组又向步骤3的溶液中滴加新制氯水,发现溶液红色褪去。可能的原因及验证方法为__________________。
(4)上述装置还有不妥之处,改进措施为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关食品添加剂的说法中,正确的是
A.胭脂红是一种常见的疏松剂
B.山梨酸钾是一种常见的防腐剂
C.碳酸氢钠具有碱性,是一种常见的调味剂
D.胡萝卜素是一种人工食用色素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
①化合反应一定是氧化还原反应 ②复分解反应都不是氧化还原反应 ③有单质生成的分解反应一定是氧化还原反应 ④置换反应一定是氧化还原反应
A. ①②④ B. ①②③ C. ②③④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 因为氢氟酸显弱酸性,可用于雕刻玻璃
B. 因为液态氨气化时吸热,可用液态氨作制冷剂
C. 明矾溶于水生成氢氧化铝胶体,起消毒杀菌的作用
D. 用铝制容器盛放浓硝酸,是因为铝和浓硝酸不反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。

(1)下列___________ (填写编号)组成元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、i ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
A.原子核对核外电子的吸引力
B.形成稳定结构的倾向。
Ⅱ.下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):
锂 | X | Y | |
失去第一个电子 | 519 | 502 | 580 |
失去第二个电子 | 7 296 | 4 570 | 1 820 |
失去第三个电子 | 11 799 | 6 920 | 2 750 |
失去第四个电子 | 9 550 | 11600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子所需的能量远远大于失去第一个电子所需的能量。
____________________________。
②表中X可能为以上13种元素中的__________ (填写字母)元素。用元素符号表示X和j形成化合物的化学式: __________。
③Y是周期表中__________族元素。
④以上13种元素中, __________ (填写字母)元素原子失去核外第一个电子需要的能量最多。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌﹣锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)![]() Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e﹣=Mn2O3(s)+2OH﹣(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与有机物的结构、性质有关的叙述不正确的是( )
A.甲烷和乙烯都可以与氯气反应,反应类型不同
B.蔗糖、油脂、蛋白质都可以水解
C.乙烯和氯乙烯都可以通过聚合反应得到高分子材料
D.乙醇和乙酸都存在碳氧双键,二者可以发生酯化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com