
 ��ҵ�ϲ��õ�һ����ˮ�����������£�������ˮ��pH��5.0��6.0֮�䣬ͨ���������Fe��OH��3��Fe��OH��3���������ԣ�����������������������о���ˮ�����ã��������������ݰ���ˮ�����������ˮ���γɸ����㣬��ȥ����Ʋ���������㣬�����˸�ѡ���������ã�ij����С���ø�ԭ��������ˮ�����װ����ͼ��ʾ������˵����ȷ���ǣ�������
��ҵ�ϲ��õ�һ����ˮ�����������£�������ˮ��pH��5.0��6.0֮�䣬ͨ���������Fe��OH��3��Fe��OH��3���������ԣ�����������������������о���ˮ�����ã��������������ݰ���ˮ�����������ˮ���γɸ����㣬��ȥ����Ʋ���������㣬�����˸�ѡ���������ã�ij����С���ø�ԭ��������ˮ�����װ����ͼ��ʾ������˵����ȷ���ǣ�������| A�� | Ϊ��ʹ��ȼ�ϵ�س�ʱ���ȶ����У���صĵ�������Ӧ�����ȶ�����ع���ʱ��ѭ��������AΪCO2 | |
| B�� | ��װ���������ķ�ӦΪFe-2e-�TFe2+ | |
| C�� | Ϊ��������ˮ�ĵ���������Ӧ����ˮ������������NaOH��Һ | |
| D�� | ����װ������1.6 g CH4�μӷ�Ӧ����C�缫���������������ڱ�״����Ϊ4.48 L |
���� ȼ�ϵ���У����������ķ�Ӧ�������õ��ӱ���ԭ�Ĺ��̣����������ķ�Ӧ��ȼ��ʧ���ӱ������Ĺ��̣������������̼����Ϊ����ʣ�����ѭ�����õ�����ֻ�ж�����̼������ȼ�ϵ���У����������ķ�Ӧ�Ǽ���ʧ���ӱ������Ĺ��̣��缫��ӦʽΪCH4+4CO32--8e-=5CO2+2H2O�����Ե��ʱ���������������Ҫ����Fe-2e-=Fe2+��CΪ�����������������ӵõ��������������ݴ˷�����
��� �⣺A�������������̼����Ϊ����ʣ�����ѭ�����õ�����ֻ�ж�����̼��ʹ��ȼ�ϵ�س�ʱ���ȶ����У���ع���ʱ���� �в���A���ʲμ�ѭ����A������CO2����A��ȷ��
B��CΪ�����������������ӵõ����������������װ���������ķ�ӦΪ2H++2e-=H2������B����
C��������ˮ��pH��5.0��6.0֮�䣬��NaOH��ʹ��Һ��pH���C����
D������װ������1.6 g ��0.1molCH4�μӷ�Ӧ���ɵ缫����ʽCH4+4CO32--8e-=5CO2+2H2O��֪ת�Ƶ���Ϊ0.8mol�����ʱ������ӦʽΪ2H++2e-=H2���������ɵ�����Ϊ0.4mol�����������ڱ�״����Ϊ8.96 L����D����
��ѡA��
���� ���⿼��ԭ��غ͵��ص�֪ʶ����Ϊ�ۺϣ�����ʱע�������غ��˼��ȥ���ͬʱע��缫��Ӧʽ����д�Լ������غ��ڼ����е�Ӧ�ã���Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| ���� | �� | �� | �� |
| ��Ӧ���Ͷ���� | 3molH2��2molN2 | 6molH2��4molN2 | 2molNH3 |
| �ﵽƽ���ʱ��/min | 5 | 8 | |
| ƽ��ʱN2��Ũ��/mol•L-1 | c1 | 1.5 | |
| NH3��������� | W1 | W3 | |
| ���������ܶ�/g•L-1 | ��1 | ��2 |
| A�� | �������з�Ӧ�ӿ�ʼ����ƽ��ķ�Ӧ����Ϊv��H2��=1.5mol•L-1•min-1 | |
| B�� | 2c1��1.5 | |
| C�� | 2��1=��2 | |
| D�� | �ڸ��¶��¼������з�Ӧ��ƽ�ⳣ��K=$\frac{��2-2{c}_{1}��^{2}}{{c}_{1}��3{c}_{1}-1.5��^{3}}$ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ũ����ϡ��ʱ��Ӧ��ˮ��������������Ũ�����У��������ò��������� | |
| B�� | Ũ����ֽ⣬���ӷ������Կ��Գ��ڷ����ڿ����� | |
| C�� | Ũ������������ԣ�ϡ������������ | |
| D�� | �������������۳����������Ũ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ԭ�Ӱ뾶��W��Y��M | |
| B�� | ��X��Y��Z��M����Ԫ���γɵĻ�����һ���������Ӽ������й��ۼ� | |
| C�� | W��Z�γɵĻ��������������������ʵ���֮�Ⱦ�Ϊ1��2 | |
| D�� | ��XԪ���γɵĵ��ʲ�һ����ԭ�Ӿ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �¶�/��C | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
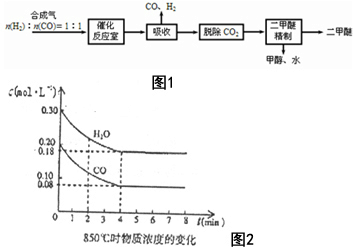 �����ѣ�CH3OCH3����һ����ࡢ��Ч�����������Ļ������ܵĿ�ȼ�����Ϊ21���͵�������Դ����ҵ�Ʊ������ѵ�����������ͼ1��
�����ѣ�CH3OCH3����һ����ࡢ��Ч�����������Ļ������ܵĿ�ȼ�����Ϊ21���͵�������Դ����ҵ�Ʊ������ѵ�����������ͼ1���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| ѡ�� | ʵ������ | ʵ������ | ʵ����� |
| A | ������ˮ���������в����裬�ټ���Ũ���ᣬѸ�ٽ��� | ������ڣ�������ͣ��γ����ɶ������ | ֻ������Ũ�������ˮ�� |
| B | ��ͭƬ����Ũ������ | ������������ɫ���壬��Һ��Ϊ����ɫ | ������Ũ�����ǿ�����Ժ����� |
| C | �����������������Һ��ַ�Ӧ��������ϡ�����ữ���ټ�����������Һ | ���ɵ���ɫ���� | �������к�����Ԫ�� |
| D | ����ˮ���뱽�в������ | ��ˮ��ɫ�²��л���Ϊ�Ⱥ�ɫ | �����巢������ȡ���� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������ˮ�ε����۵⻯����ֽ�ϣ������ֽ�ȱ������ף�˵���������������Ժ�Ư���� | |
| B�� | ��Na2S2O3ϡ��Һ�м���ϡ���ᣬ�������·�Ӧ��S2O32-+2H+�TSO2��+S��+H2O�����ò������ǵĿ�����������ݵĿ������Բⶨ�÷�Ӧ�ڲ�ͬ�����µķ�Ӧ���� | |
| C�� | ���������������Ҵ����ʿɼ�ˮ��ȥ����ԭ������ˮ�м����Ȼ�̼��ȡ������ | |
| D�� | ��SO2ͨ��Ʒ����Һ�У�Ʒ����Һ��ɫ��������ɫ�����Һ���ָ���ɫ��˵��������ȶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | ���̢��У�FeS��O2��H2SO4��Ӧ�Ļ�ѧ����ʽ��4FeS+3O2+6H2SO4�T2Fe2��SO4��3+6H2O+4S | |
| B�� | ���̢��в����������Դ��������Ⱦ����ѡ������ˮ���� | |
| C�� | ���̢��У���Ҫ���������������ϡ���� | |
| D�� | ���̢��е�ʵ������������ᾧ����ȴ�����ˡ�ϴ�� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com