

| A. | 装置①中,盐桥中的K+移向ZnSO4溶液 | |
| B. | 装置②工作一段时间后,a极附近溶液的pH增大 | |
| C. | 用装置③精炼铜时,c极为粗铜 | |
| D. | 装置④电池负极的电极反应式为:O2+4e-+2H2O=4OH- |
分析 A.Zn比Cu活泼,Zn失去电子为负极;
B.a与电源的负极相连,为阴极,氢离子在阴极上放电;
C.粗铜精炼时,粗铜为阳极;
D.为燃料电池,正极上氧气得到电子.
解答 解:A.Zn比Cu活泼,Zn失去电子为负极,阳离子向正极移动,则盐桥中的K+移向CuSO4溶液,故A错误;
B.a与电源的负极相连,为阴极,氢离子在阴极上放电,则装置②工作一段时间后,a极上OH-浓度增大,a极附近溶液的pH增大,故B正确;
C.粗铜精炼时,粗铜为阳极,d与正极相连,则d极为粗铜,故C错误;
D.为燃料电池,正极上氧气得到电子,则正极反应式为:O2+4e-+2H2O=4OH-,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及原电池、电解原理及应用等,把握反应原理及实验技能为解答的关键,侧重分析与实验能力的考查,注意实验装置的作用及分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
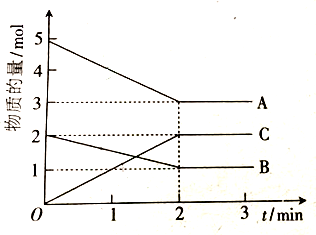
| 实验组 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | 达到平衡所需的时间/min | ||||
| CO | H2 | CH3OH | CO | H2 | CH3OH | |||
| 1 | 650℃ | 2.0 | 6.0 | 0 | 1.0 | 5 | ||
| 2 | 900℃ | 2.0 | 6.0 | 0 | 1.2 | 2 | ||
| 3 | 650℃ | 1.0 | 4.0 | 2.0 | a | b | c | t |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
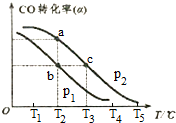
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
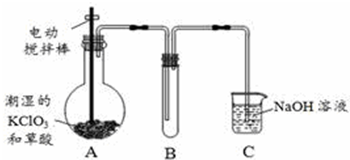
 肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料.实验室用下列反应制取肉桂酸.
肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料.实验室用下列反应制取肉桂酸.
| 苯甲醛 | 乙酸酐 | 肉桂酸 | 乙酸 | |
| 溶解度(25℃,g/100g水) | 0.3 | 遇热水水解 | 0.04 | 互溶 |
| 沸点(℃) | 179.6 | 138.6 | 300 | 118 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 对于A(s)+2B(g)?3C(g)△H>0,若平衡时C的百分含量跟条件X、Y的关系如图①所示则Y可能表示温度,x可能表示压强,且Y3>Y2>Y1 | |
| B. | 已知可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-1025kJ•mol-1.若反应物起始物质的量相同,则图②可表示温度对NO的百分含量的影响 | |
| C. | 已知反应2A(g)?B(?)+2C(?);△H=+QKJ/mol(Q>0),满足如图③所示的关系,则B、C可能均为气体 | |
| D. | 图④是恒温下某化学反应的反应速率随反应时间变化的示意图,则该反应的正反应是一个气体体积增大的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
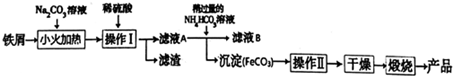
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com