
W、M、N、X、Y、Z是五种常见的短周期元素,其原子半径随原子序数变化如右图所示。已知W的一种核素的质量数为18,中子数为10;M和Ne原子的核外电子数相差1;N与X相邻;X的单质是一种常见的半导体材料;Y的最外层电子数是其最内层电子数的3倍;Z的非金属性在同周期主族元素中最大。
(1)元素X在周期表中的位置是_______________;元素Y的离子结构示意图为____________
(2)下列有关物质性质的比较中.正确的是________________
| A.M、X、Z形成的单质熔沸点 M>X>Z |
| B.氢化物的热稳定性:W>X |
| C.X分别与W和Z形成的化合物中化学键类型,晶体类型均相同 |
| D.Z元素含氧酸的酸性一定强于Y元素的含氧酸 |
(1)第三周期第IVA族(1+1分);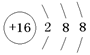 (2分)
(2分)
(2)B(2分)
(3)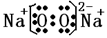 (2分)
(2分)
(4)极性(2分)
(5)HF(2分)
(6)Al3+ + 3AlO2﹣+ 6H2O = 4Al(OH)3↓(2分)
解析试题分析:(1)X单质是一种半导体材料,所以X为硅元素,Y的最外层电子数是最内层电子数的三倍又在硅元素后面,所以Y是硫元素;
(2)推断W为氧,M是钠,N是铝,X是硅,Y是硫,Z是氯,A、M、X、Z形成的单质熔沸点X>M>Z,错误;B、正确;C、硅和氧形成的是共价键,硅和氯形成的是离子键,错误;D、盐酸的酸性没有硫酸的强,错误。
(3)过氧化钠中既有共价键也有离子键;
(4)氯元素以离子键与别的元素结合,含有离子键,所以为极性分子;
(5)卤素氢化物的水溶性HF>HCl>HBr>HI;
(6)铝离子和偏铝酸根离子能发生双水解。
考点:常见的短周期元素。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,Y原子最外层电子数是其周期数的三倍,Z与X原子最外层电子数相同。回答下列问题:
(1)X、Y和Z的元素符号分别为______、______、______。
(2)由上述元素组成的化合物中,既含有共价键又含有离子键的有________、________。
(3)X和Y组成的化合物中,既含有极性共价键又含有非极性共价键的是________。
此化合物在酸性条件下与高锰酸钾反应的离子方程式为__________________________。
此化合物还可将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等。
| | Q | R | |
| T | | | W |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。用化学用语回答下列问题。
| a | | | |||||||||||||||
| | | | | | | | | | | | | b | c | d | | | |
| e | | f | g | | h | i | | ||||||||||
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B,C形成电子总数为10的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数为18的气体分子。请回答下列问题(题中的字母只代表元素代号,与实际元素符号无关);
(1)A~F六种元素原子,原子半径最大的是 (填元素符号),B元素在元素周期表中的位置 。
(2)D与E可形成化合物D2E,该化合物的电子式为 。
(3)A、C、E三种元素形成的一种常见化合物,其浓溶液在加热条件下可与碳反应,该反应的化学方程式为 ________________________________。
(4)比较E、F气态氢化物的稳定性: > (用分子式表示)。
(5)请写出:CH3OH和O2与KOH溶液组成的燃料电池总反应式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
短周期元素X、Y、Z、W原子序数依次增大。X氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中。请回答:
(1)X氢化物的电子式是_________________________________________。
(2)X氢化物的水溶液与W氢化物的水溶液混合后恰好反应时,溶液呈(填“酸”、“碱”或“中”)性,用离子方程式表示其原因是_____________________________________.
(3)Y—AgO电池是应用广泛的鱼雷电池,其原理如图所示。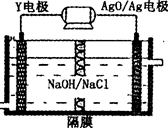
该电池的负极反应式是___________________________________。
(4)Z和W比较,非金属性较弱的是_______________(填元素符号),下列不能验证这一结论的是________(填序号)。
a.元素在地壳中的含量
b.最高价氧化物对应水化物的酸性
c.断开氢化物中1 mol H—Z或H—W键所需的能量
d.Z与W以共价键形成化合物时,Z或W显示的电性
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、M、D、E是原子序数依次增大的五种短周期元素。A元素的一种原子中不含中子。B、M、D、E分别在下表(周期表的一部分)不同的空格内占有相应的位置,E的原子序数是D的原子序数的2倍。试回答: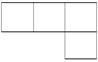
(1)A元素是________ 。
(2)在B、M、D、E四种元素的最简单氢化物中,沸点最高的是__________(填化学式)。
(3)A、B、M、D可组成多种18电子分子,写出 2种具有18电子的有机物的结构简式______、______。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有X、Y、Z、W四种元素,它们的单质X、Y、Z在常温常压下皆为气体,W为固体。
①X单质可在Z单质中燃烧生成XZ,其火焰为苍白色;W单质在Y单质中剧烈燃烧产生黄色火焰,生成W2Y2;
②每2molX2可与1molY2化合生成2molX2Y,X2Y在常温下为液体;
③化合物XZ的水溶液可使蓝色石蕊试纸变红;W与水反应后的溶液可使无色酚酞试液变红色;
④Z单质溶于化合物X2Y,所得溶液具有漂白作用;请回答:
(1)画出Z原子的原子结构示意图 ;实验室中的W应保存在____________中(填试剂名称)
(2)写出化学式W2Y2___________ _K#S5U
(3)写出与W+具有相同核外电子数的分子或原子,请写出任意3种的化学式
① ② ③
(4)Z单质与水反应的离子方程式:_________________________
⑸W单质与X2Y化学反应方程式:__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D四种主族元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,A与D为同一主族,C元素的价电子排布为ns2πp2n,D在空气中燃烧可以得到淡黄色固体。又知四种元素分别形成的常见单质在常温常压下有三种是气体,一种是固体。请回答下列问题:
(1)D在元素周期表中的位置是 。
(2)比较元素B和C的第一电离能:B C(填“大于”、“小于”或“不确定”),将BA3通入溴水中可发生反应,生成B的单质和一种盐Y,B的单质中的σ键和π键个数比为 ,盐Y的晶体类型是 。
(3)D与A形成的粒子个数比为1:1的简单化合物可与水反应生成A的单质,该反应的化学方程式为 。
(4)已知B2A4和过氧化氢混合可作火箭推进剂。12.8g液态B2A4与足量过氧化氢反应生成B的单质和气态水,放出256.65kJ的热量:
写出液态B2A4和氧气反应生成B的单质和液态A2C的热化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com