
| A. | 只有金属钋原子采用这种堆积方式 | B. | 这种堆积方式中,配位数为8 | ||
| C. | 这是金属晶体的一种最密堆积方式 | D. | 这种堆积方式的空间利用率较低 |
分析 A.Po采取简单立方堆积;
B.面心立方最密堆积、配位数为12;
C.空间利用率最高的结构为六方最密堆积和面心立方最密堆积;
D.根据不同堆积方式的空间利用率解答.
解答 解:A.Po采取简单立方堆积 ,故A错误;
,故A错误;
B.在金属晶体的最密堆积中,对于每个原子来说,在其周围的原子有与之同一层上有六个原子和上一层的三个及下一层的三个,故每个原子周围都有12个原子与之相连,配位数为12,故B错误;
C.金属的堆积模型有简单立方堆积,体心立方堆积和面心立方堆积,这是金属晶体面心立方最密堆积,空间利用率为74%,是金属晶体的一种最密堆积方式,故C正确;
D.简单立方堆积(Po型)空间利用率为52%,体心立方堆积,属于钾、钠和铁型,空间利用率68%;六方最密堆积,属于镁、锌、钛型,空间利用率为74%,面心立方最密堆积(Cu型)空间利用率为74%,这种堆积方式的空间利用率较高,故D错误;
故选C.
点评 本题主要考查了晶体的堆积方式与配位数和空间利用率,题目难度中等,注意掌握典型晶体晶胞结构,明确晶胞中配位数、原子个数的计算方法,为学习的难点.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA | |
| B. | 18g D2O含有的电子数为10NA | |
| C. | 在标准状况下,22.4LSO3的物质的量为1mol | |
| D. | 同温、同压下,相同体积的氟气和氩气所含的原子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
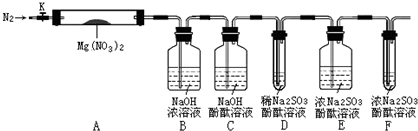
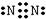 ,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.
,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
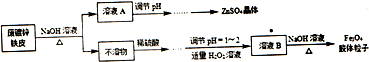
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+、K+、NO3-、Cl- | B. | Na+、Ba2+、Br-、SO32- | ||
| C. | H+、Na+、SiO32-、Cl- | D. | H+、Fe3+、I-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲酸乙酯的结构简式:HCOOCH2CH3 | |
| B. | 质子数为53,中子数为75的碘原子:${\;}_{53}^{128}$I | |
| C. | 四氯化碳的电子式: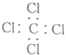 | |
| D. | 间甲基苯酚: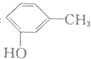 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
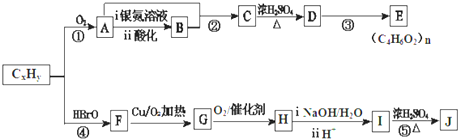

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
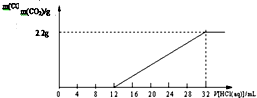 某碳酸钾和碳酸氢钾的混合样品61.4g,加水溶解后,取所得溶液的$\frac{1}{10}$,向其中缓缓加入一定浓度的稀盐酸,并同时记录放出CO2的质量和消耗稀盐酸的体积,得到如图所示的曲线,下列说法不正确的是( )
某碳酸钾和碳酸氢钾的混合样品61.4g,加水溶解后,取所得溶液的$\frac{1}{10}$,向其中缓缓加入一定浓度的稀盐酸,并同时记录放出CO2的质量和消耗稀盐酸的体积,得到如图所示的曲线,下列说法不正确的是( )| A. | 该过程所发生反应的化学方程式:K2CO3+HCl═KCl+KHNO3,KHNO3+HCl═KCl+H2O+CO2↑ | |
| B. | 混合样品中碳元素的质量分数为8.5% | |
| C. | 混合样品中含碳酸钾41.4g | |
| D. | 将原混合液体充分加热后,再加入足量的盐酸,整个过程中产生的CO2总量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 选用试剂 |
| A | 探究Cl2、Br2、I2的氧化性强弱顺序 | 氯水、溴水、KI溶液 |
| B | 探究化学反应的能量变化 | Ba(OH)2•8H2O、NH4Cl晶体 |
| C | 证明海带灰中含有碘元素 | 海带灰、稀硫酸、3%的H2O2溶液、淀粉溶液 |
| D | 证明淀粉是否水解 | 淀粉溶液、稀硫酸、NaOH溶液、银氨溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com