
| A. | a克CH4在氧气中完全燃烧,将其产物全部跟足量的过氧化钠完全反应,反应后固体质量恰好也增加a克 | |
| B. | 将等物质的量的Na2O和Na2O2分别投入到足量且等质量的水中,得到溶质质量分数相等 | |
| C. | 1mol Na2O2与2mol NaHCO3固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是Na2CO3 | |
| D. | 向某溶液中加入氯水,然后再加入KSCN溶液变红色,说明原溶液中含有Fe2+ |
分析 A.有机物在足量氧气中燃烧生成CO2和H2O,与Na2O2发生反应:2Na2O2+CO2=2Na2CO3+O2↑,2Na2O2+2H2O=4NaOH+O2↑,对生成物变式:Na2CO3~Na2O2•CO,2NaOH~Na2O2•H2,固体增加的质量相当于CO和H2的质量;
B.Na2O和Na2O2物质的量相等且由方程式易知,Na2O2放在溶液中增加的质量为Na2O2中的Na2O部分,由此可知两溶液的质量相同;
C.碳酸氢钠不稳定,加热易分解,发生反应:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2,由于二氧化碳与氢氧化钠反应生成碳酸钠,可以认为过氧化钠先与二氧化碳反应,再与水反应;
D.Fe3+与KSCN溶液变血红色.
解答 解:A.有机物在足量氧气中燃烧生成CO2和H2O,与Na2O2发生反应:2Na2O2+CO2=2Na2CO3+O2↑,2Na2O2+2H2O=4NaOH+O2↑,对生成物变式:Na2CO3~Na2O2•CO,2NaOH~Na2O2•H2,固体增加的质量相当于CO和H2的质量,故固体增加质量大于ag,故A错误;
B.反应方程式为:Na2O+H2O=2NaOH,2Na2O2+2H2O=4NaOH+O2↑,
设物质的量都为1mol,则Na2O+H2O=2NaOH△m
1mol 2mol 62g
2Na2O2+2H2O=4NaOH+O2↑△m
1mol 2mol 62g
由方程式可知,生成溶质的物质的量相等,则溶质的质量相等,反应后两溶液的质量相等,则两溶液溶质质量分数相等,故B正确;
C.由方程式:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,可知2mol NaHCO3分解得到Na2CO3、CO2和H2O各1mol,还会发生反应:2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2,由于二氧化碳与氢氧化钠反应生成碳酸钠,可以认为过氧化钠先与二氧化碳反应,再与水反应,Na2O2只有1mol,恰好和CO2反应生成1molNa2CO3和O2,气体排出后,只剩余Na2CO3,故C正确;
D.Fe3+与KSCN溶液变血红色,故原溶液中可能有Fe3+,故D错误.
故选:BC
点评 本题选择题难度中等,会写方程式是分析选项的关键,并且知道Fe3+与KSCN溶液变血红色的特殊现象.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
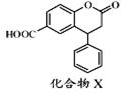
| A. | 可以与饱和Na2CO3溶液反应 | |
| B. | 分子中两个苯环一定处于同一平面 | |
| C. | 在酸性条件下水解,水解产物只有一种 | |
| D. | 1 mol化合物X最多能与3 mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl在水溶液中的沉淀溶解平衡方程式是AgCl(s)?Ag+(aq)+Cl-(aq) | |
| B. | AgCl在水溶液中的电离方程式是AgCl=Ag++Cl- | |
| C. | 反应aA(g)?bB(g)+cC(g)达到平衡以后,增大A的物质的量浓度,A的转化率一定减小 | |
| D. | 钢铁发生电化学腐蚀时负极反应式为Fe-e-=Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序:r(W)>r(Z)>r(Y) | |
| B. | 元素Z、W的简单离子的离子半径大小:W+>Z2- | |
| C. | 元素Y的简单气态氢化物的热稳定性比Z的强 | |
| D. | 只含X、Y、Z三种元素的化合物,可能是离子化合物,也可能是共价化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com