
| A. | 澄清石灰水中滴加少量的小苏打溶液:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- | |
| B. | 铵明矾[NH4Al(SO4)2•12H2O]溶液中加入过量Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O | |
| C. | 过氧化钠和水反应:2O22-+2H2O═4OH-+O2↑ | |
| D. | H2O2溶液中滴加酸性KMnO4溶液:2MnO4-+5 H2O2+6H+═2Mn2++5O2↑+8H2O |
分析 A.二者反应生成碳酸钙、氢氧化钠和水;
B.漏掉铵根离子与氢氧根离子反应;
C.过氧化钠应保留化学式;
D.二者发生氧化还原反应,生成氧气和水、二价锰离子.
解答 解:A.澄清石灰水中滴加少量的小苏打溶液,离子方程式:Ca2++OH-+HCO3-═CaCO3↓+H2O+OH-,故A错误;
B.铵明矾[NH4Al(SO4)2•12H2O]溶液中加入过量Ba(OH)2溶液离子方程式,NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+2H2O+NH3•H2O,故B错误;
C.过氧化钠和水反应,离子方程式:2Na2O2+2H2O═4Na++4OH-+O2↑,故C错误;
D.H2O2溶液中滴加酸性KMnO4溶液,离子方程式:2MnO4-+5 H2O2+6H+═2Mn2++5O2↑+8H2O,故D正确;
故选:D.
点评 本题考查了离子方程式书写,明确反应实质是解题关键,注意反应物用量对反应的影响,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL | |
| B. | 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L | |
| C. | NO2和N2O4 的混合气体中,NO2的体积分数是80% | |
| D. | 该合金中铜与镁的物质的量之比是2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
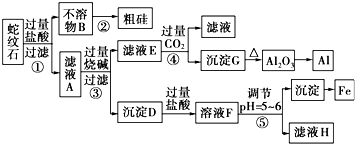
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol Cl2参加反应,转移的电子数目一定为0.2NA | |
| B. | 1.4g聚乙烯中含C-H数目为0.2NA | |
| C. | 标准状况下,5.6L甲醇中含有的分子数目为0.2NA | |
| D. | 常温下,pH=13的NaOH溶液中含OH-的数目为0.1NAA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 叠氮化钠(NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起.实验室测定叠氮化钠样品中NaN3的质量分数.实验步骤如下:
叠氮化钠(NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起.实验室测定叠氮化钠样品中NaN3的质量分数.实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电池.甲醇燃料电池的工作原理如图所示.
中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电池.甲醇燃料电池的工作原理如图所示. 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com