
下图是用未知浓度的NaOH溶液来滴定10mL盐酸(标准液)所得的曲线(25℃),则下列说法不正确的是( )
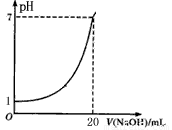
A.标准液盐酸的浓度为0.1 mol/L
B.NaOH溶液的浓度为0.05 mol/L
C.滴定终点时,俯视碱式滴定管读数,所测NaOH溶液浓度会偏高
D.指示剂变色时,说明盐酸与NaOH恰好完全反应
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源:2009届山东师范大学附属中学高三年级第二次月考、化学试卷 题型:058
关于酸碱中和滴定
(1)准确量取25.00 ml高锰酸钾溶液,选用的仪器是________(酸式或碱式)滴定管.
(2)一只规格为a mL的滴定管,其尖嘴部分充满溶液,管内液面在m mL处,当液面降到n mL处时,流出液体的体积为________ml.
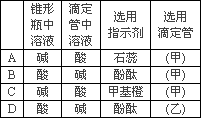
(3)用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考下图,从下表中选出正确选项________.

(4)某学生用0.1 mol·L-1的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:
A.量取20 mL待测盐酸注入洁净的锥形瓶,并加入2~3滴酚酞
B.用标准溶液润洗滴定管2~3次
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准KOH溶液注入碱式滴定管至“0”刻度以上1~2 cm
E.调节液面至“0”或“0”以下刻度,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度就此实验完成填写:
①正确操作步骤的顺序是(用序号字母填写)________;
②判断到达滴定终点的实验现象是________;
③滴定过程中眼睛________,左手________,右手________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com