
铝广泛应用于化学工业和日常生活中。工业上由铝土矿(Al2O3·3H2O的含量约为85%,其余主要为SiO2、Fe2O3等)冶炼金属铝的流程如下。
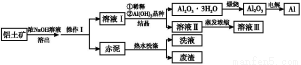
已知拜耳法生产Al2O3·3H2O的基本原理为:
Al2O3·3H2O+2NaOH(aq)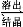 2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2Al(OH)3]
2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2Al(OH)3]
(1)操作Ⅰ的名称为 ,赤泥中除含有铝硅酸盐外,还含有的主要物质有 。
(2)为了提高铝土矿的溶出速率可采取的有效措施为 (任写三点)。
(3)用化学平衡理论解释稀释溶液Ⅰ有利于Al2O3·3H2O 结晶的原因 。
(4)为了析出Al2O3·3H2O,也可向溶液Ⅰ中通入过量CO2气体,写出生成Al2O3·3H2O的离子方程式: 。
(5)为了回收赤泥附着液带走的有用成分,工业上将用热水洗涤后的洗液用作溶液Ⅰ的稀释剂,请指出流程图中另一处类似的做法 。
(1)过滤 Fe2O3
(2)将铝土矿粉碎、加热、搅拌、增大NaOH的浓度(任答三点即可)
(3)稀释降低了NaOH的浓度,有利于NaAlO2的水解,使平衡向结晶方向移动(或向左移动)
(4)CO2(过量)+Al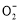 +2H2O
+2H2O Al(OH)3↓+HC
Al(OH)3↓+HC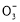 或2CO2(过量)+2Al
或2CO2(过量)+2Al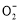 +4H2O
+4H2O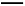 Al2O3·3H2O↓+2HC
Al2O3·3H2O↓+2HC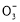
(5)将溶液Ⅲ循环使用溶解铝土矿
【解析】流程原理分析如下:铝土矿(Al2O3、SiO2、Fe2O3)经NaOH溶液处理,Al2O3、SiO2转化为NaAlO2、Na2SiO3,然后过滤,滤出的Fe2O3成为赤泥。对于NaAlO2、Na2SiO3的混合液,经稀释,NaOH浓度降低,使NaAlO2的水解平衡向结晶方向移动(或向左移动),从而得到Al(OH)3(Al2O3·3H2O),然后煅烧去水得到Al2O3,电解熔融Al2O3得到金属Al。在促使Al(OH)3(Al2O3·3H2O)析出的过程中也可以用通入CO2气体的方法,通过反应CO2(过量)+Al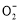 +2H2O
+2H2O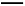 Al(OH)3↓+HC
Al(OH)3↓+HC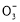 得到Al(OH)3。溶液Ⅱ主要是析出Al(OH)3后,残留有NaAlO2、Na2SiO3的NaOH溶液,经蒸发浓缩可以继续溶解铝土矿。
得到Al(OH)3。溶液Ⅱ主要是析出Al(OH)3后,残留有NaAlO2、Na2SiO3的NaOH溶液,经蒸发浓缩可以继续溶解铝土矿。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源:2014高考化学名师知识点精编 专题19烃的衍生物基础营养物质练习卷(解析版) 题型:选择题
下列关于有机物的说法中正确的是( )
A.乙醇、乙酸、乙酸乙酯都能发生取代反应,且都有同分异构体
B.汽油、煤油、植物油均为含碳、氢、氧三种元素的化合物
C.纤维素和淀粉都能发生水解,但水解的最终产物不同
D.丁烷与戊烷分子内碳原子数相差一个,但同分异构体数却相差两个
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题15富集在海水的元素-氯溴碘练习卷(解析版) 题型:选择题
某同学用下列装置制备并检验Cl2的性质。下列说法正确的是( )
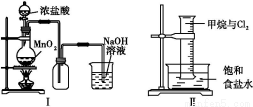
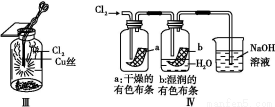
A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗
B.Ⅱ图中:量筒中发生了加成反应
C.Ⅲ图中:生成蓝色的烟
D.Ⅳ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题13铁、铜及其重要化合物练习卷(解析版) 题型:实验题
某化学小组在学习元素周期律后,对教材中Fe2+氧化为Fe3+的实验进一步思考,并提出问题:Cl2能将Fe2+氧化为Fe3+,那么Br2和I2能否将Fe2+氧化为Fe3+?
环节一:理论推测
部分同学认为Br2和I2都可能将Fe2+氧化为Fe3+,他们思考的依据是 。
部分同学认为Br2和I2都不能将Fe2+氧化为Fe3+,还有同学认为Br2能将Fe2+氧化为Fe3+而I2不能。他们思考的依据是从上到下卤素单质氧化性减弱。
环节二:设计实验进行验证
在大试管中加适量铁粉,加入10 mL稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验。
实验1:
试管 | 操作 | 现象 |
① | 先向试管中加入2 mL FeCl2溶液,再滴加少量红棕色的溴水,振荡试管 | 溶液为黄色 |
② | 先向试管中加入2 mL FeCl2溶液,再滴加少量棕黄色的碘水,振荡试管 | 溶液为黄色 |
环节三:实验现象的分析与解释
(1)同学甲认为①中现象说明溴水能将Fe2+氧化,离子方程式为 。
同学乙认为应该补充实验,才能得出同学甲的结论。请你帮助同学乙完成实验:
实验2:
操作 | 应该观察到的现象 |
|
|
(2)该小组同学对②中溶液呈黄色的原因展开了讨论:
可能1:碘水与FeCl2溶液不反应,黄色是碘水稀释后的颜色。
可能2: 。
实验3:进行实验以确定可能的原因。
操作 | 现象 |
向试管②所得溶液中继续加入0.5 mL CCl4,充分振荡,静置一段时间后。取出上层溶液,滴加KSCN溶液 | 静置后,上层溶液几乎无色,下层溶液为紫色;上层溶液滴加KSCN溶液后,出现浅红色 |
同学丙认为该实验现象可以说明是“可能2”成立,同学丁认为不严谨,于是设计了实验4:
实验4:
操作 | 现象 |
向另一支试管中加入2 mL FeCl2溶液,滴加0.5 mL碘水后,再加入0.5 mL乙酸乙酯,充分振荡,静置一段时间后。取出下层溶液,滴加KSCN溶液 | 静置后,上层液为紫色,下层液几乎无色;下层溶液滴加KSCN溶液后,没有出现浅红色 |
你认为实验4设计的主要目的是 。
同学丁根据实验4现象得出结论:在本次实验条件下,碘水与FeCl2溶液反应的程度很小。
(3)Cl2、Br2、I2氧化Fe2+的能力逐渐减弱,用原子结构解释原因: 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题13铁、铜及其重要化合物练习卷(解析版) 题型:选择题
向100 mL 18 mol/L的硫酸中加入足量铜片,加热并充分反应。下列有关说法正确的是( )
A.充分反应后转移1.8 mol电子
B.H2SO4只作氧化剂
C.若不加热应生成H2
D.消耗的铜的质量一定少于57.6 g
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题12钠、铝及其重要化合物练习卷(解析版) 题型:选择题
工业上可用硫酸铝与硫磺焙烧制备氧化铝:2Al2(SO4)3+3S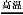 2Al2O3+9SO2↑,下列有关说法中正确的是( )
2Al2O3+9SO2↑,下列有关说法中正确的是( )
A.反应中Al2(SO4)3被氧化
B.Al2 (SO4)3、Al2O3均含有离子键和共价键
C.5.1 g Al2O3含有9.03×1022个阴离子
D.该反应中,每转移0.3 mol电子生成5.04 L SO2
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题11电化学练习卷(解析版) 题型:选择题
工业上常用Fe作电极电解处理含Cr2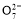 的酸性废水,最终使铬元素以Cr(OH)3沉淀的形式除去。某科研小组用该原理处理污水,设计装置如图所示。下列说法一定不正确的是( )
的酸性废水,最终使铬元素以Cr(OH)3沉淀的形式除去。某科研小组用该原理处理污水,设计装置如图所示。下列说法一定不正确的是( )
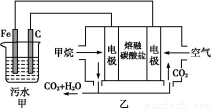
A.燃料电池中若有1.6 g CH4参加反应,则甲中C电极理论上生成气体体积为8.96 L
B.实验时若污水中离子浓度较小,导电能力较差,可加入适量的Na2SO4
C.该燃料电池正极的电极反应式为:O2+4e-+2CO2=2C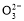
D.甲中阳极附近溶液中的离子反应方程式是:Cr2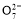 +6Fe2++14H+=2Cr3++6Fe3++7H2O
+6Fe2++14H+=2Cr3++6Fe3++7H2O
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题10盐类水解与沉淀溶解平衡练习卷(解析版) 题型:选择题
下列说法中正确的是( )
A.难溶电解质在水溶液中达到沉淀溶解平衡时,沉淀和溶解即停止
B.Ksp越小,难溶电解质在水中的溶解能力一定越弱
C.Ksp的大小与离子浓度无关,只与难溶电解质的性质和温度有关
D.相同温度下,AgCl在水中的溶解能力与在NaCl溶液中的相同
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题8电解质溶液练习卷B(解析版) 题型:选择题
能说明0.1 mol·L-1的NaHA溶液一定呈酸性的是( )
①稀释时,溶液中c(OH-)增大
②溶液的pH<7
③溶液中c(Na+)=c(A2-)
④溶液可与等体积等物质的量浓度的NaOH溶液恰好反应
A.①②③④ B.①③④ C.①③ D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com