
| A、0.25 | B、2 | C、4 | D、16 |
科目:高中化学 来源: 题型:
| A、它们均由甲烷去掉一个氢原子所得 |
| B、CH3-与NH3、H3O+互为等电子体,几何构型均为三角锥形 |
| C、CH3+中的碳原子采取sp2杂化,所有原子均共面 |
| D、两个-CH3或一个CH3+和一个CH3-结合均可得到CH3CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某固体中加入稀盐酸,产生了无色气体,证明该固体一定含有CO32- |
| B、某无色溶液滴加酚酞试液显红色,该溶液不一定是碱 |
| C、某溶液中滴加了BaCl2溶液,生成不溶于稀硝酸的白色沉淀,该溶液中一定含有SO42- |
| D、验证碱溶液中是否含有Cl-,先加稀盐酸除去OH-,再加AgNO3,有白色沉淀出现证明含有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
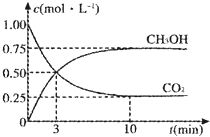 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.| 光合作用 |
| 催化剂 |
| △ |
| 催化剂 |
| △ |
| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
- 2 |
- 2 |
- 3 |
- 2 |
- 3 |
- 3 |
- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
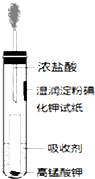 氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO K=4.5×10-4
氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO K=4.5×10-4查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5种 | B、6种 | C、9种 | D、10种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH |
| B、FeSO4 |
| C、BaCl2 |
| D、NaClO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com