
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
Mg(OH)2(s)![]() Mg2++2OH- ①
Mg2++2OH- ①
![]() +H2O
+H2O![]() NH3·H2O+H+ ②
NH3·H2O+H+ ②
H++OH-![]() H2O ③
H2O ③
由于![]() 水解显酸性,H+与OH-反应生成水,导致反应①平衡右移,沉淀溶解;
水解显酸性,H+与OH-反应生成水,导致反应①平衡右移,沉淀溶解;
乙同学的解释是
Mg(OH)2(s)![]() Mg2++2OH- ①
Mg2++2OH- ①
![]() +OH-
+OH-![]() NH3·H2O ②
NH3·H2O ②
由于NH4Cl电离出的![]() 与Mg(OH)2电离出的OH-结合,生成了弱的电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
与Mg(OH)2电离出的OH-结合,生成了弱的电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学的解释只有一种正确,他选用的试剂是_________(填写编号)。
A.NH4NO3 B.CH3COONH4 C.Na2CO3 D.NH3·H2O
(2)你说明丙同学做出该选择的理由:______________________________。
(3)丙同学将所选试剂滴入Mg(OH)2的浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理_____________(填“甲”或“乙”);完成NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
( 8分)已知氨水的电离度与醋酸的电离度在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性。现向少量的Mg(OH)2悬浊液中,加入适量的饱和氯化铵溶液,固体完全溶解。
甲同学的解释是:Mg(OH)2(固)Mg2+(aq)+2OH—(aq)…………①
NH4++H2ONH3·H2O +H+…………② H++OH―
H2O…………③
由于NH4+水解显酸性,H+与OH―反应生成水,导致反应①平衡右移,沉淀溶解;
乙同学的解释是:Mg(OH)2(固)Mg2+(aq)+2OH—(aq)……① NH4++OH―
NH3·H2O……②
由于NH4Cl电离出的NH4+与Mg(OH)2电离出的OH―结合,生成了弱的电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学的解释只有一种正确,他选用的试剂是 (填写编号)。
A.NH4NO3 B.CH3COONH4 C.Na2CO3 D.NH3·H2O
(2)请你说明丙同学作出该选择的理由 。
(3)丙同学将所选试剂滴入Mg(OH)2的浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理 (填“甲”或“乙”);完成NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2011届黑龙江省牡丹江一中高三上学期期末考试化学试卷 题型:填空题
(15分)化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
Ⅰ.有甲、乙两个容积相等的恒容密闭容器,
发生反应3A(g)+B(g)  xC(g) △H = QKJ/mol
xC(g) △H = QKJ/mol
回答下列问题:
(1)下列各项能作为判断该反应达到化学平衡状态的依据是 (填序号)
①化学反应速率:v(A)="3v(B) " ②混合气体的密度保持不变
③有3molA消耗的同时有1molB生成 ④ C的浓度保持不变
(2)根据试验测得的数据可知,温度越高该反应的化学平衡常数越大,则Q 0(填“大于”或“小于”)
(3)向甲中通入6molA和2molB,向乙中通入1.5molA、0.5molB和3molC,将两容器的温度恒定在770K,使反应3A(g)+B(g)  xc(g)达到平衡,此时测得甲、乙两容器中C的体积分数均为0.2 。
xc(g)达到平衡,此时测得甲、乙两容器中C的体积分数均为0.2 。
①若平衡时,甲、乙两容器中A的物质的量相等,则x= ;
②平衡时甲中A的体积分数为 ;
③若平衡时两容器的压强不相等,则两容器中压强之比为
Ⅱ.(1)pH=3的盐酸a L,分别与下列3种溶液混合,充分反应后溶液呈中性:
①pH=11的氨水b L;②物质的量浓度为1×10-3 mol/L 氨水c L;
③c(OH-)=1×10-3 mol/L的Ba(OH)2溶液d L;
试判断a、b、c、d的大小关系正确的是
A.a=b>c>d B.b>a=d>c C.c>a>d>b D.c>a=d>b
(2)已知室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,两溶液中c(H+) ? c(OH-)=___________;各取5mL上述溶液,分别加水稀释至50mL,pH较大的是________溶液;各取5mL上述溶液,分别加热到90℃,pH较小的是________溶液。
(3)同浓度的下列溶液:①NH4Al(SO4)2;②NH4Cl;③NH3·H2O;④CH3COONH4,其中c(NH4+) 由大到小的顺序是: (填编号)。
Ⅲ.一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数Ksp=cm(An+)×cn(Bm—),称为难溶电解质的溶度积。
(1)在25℃,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是 ;
(2)下列叙述不正确的是 (填字母)
A.溶度积小的沉淀可以转化为溶度积更小的沉淀
B.25℃时,AgCl固体在等物质的量浓度NaCl、CaCl2溶液中的溶度积相同。
C.25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同
查看答案和解析>>
科目:高中化学 来源:2012届山东省济宁市梁山二中高三12月月考化学试卷 题型:填空题
( 8分)已知氨水的电离度与醋酸的电离度在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性。现向少量的Mg(OH)2悬浊液中,加入适量的饱和氯化铵溶液,固体完全溶解。
甲同学的解释是:Mg(OH)2(固)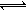 Mg2+(aq)+2OH—(aq)…………①
Mg2+(aq)+2OH—(aq)…………①
NH4++H2O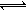 NH3·H2O +H+…………② H++OH―
NH3·H2O +H+…………② H++OH―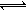 H2O…………③
H2O…………③
由于NH4+水解显酸性,H+与OH―反应生成水,导致反应①平衡右移,沉淀溶解;
乙同学的解释是:Mg(OH)2(固)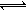 Mg2+(aq)+2OH—(aq)……① NH4++OH―
Mg2+(aq)+2OH—(aq)……① NH4++OH―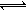 NH3·H2O……②
NH3·H2O……②
由于NH4Cl电离出的NH4+与Mg(OH)2电离出的OH―结合,生成了弱的电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学的解释只有一种正确,他选用的试剂是 (填写编号)。
| A.NH4NO3 | B.CH3COONH4 | C.Na2CO3 | D.NH3·H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com