
某溶液中含有NO3-、SiO32-、AlO2-、S2-4种离子,若向其中加入过量的盐酸,微热并搅拌,再加入过量的氢氧化钠溶液,则溶液中离子数目大量减少的是 ( )。
A.只有S2- B.S2-和NO3-
C.SiO32-、S2-和NO3- D.4种离子都减少
科目:高中化学 来源:2014年高中化学二轮创新训练上专题1物质组成分类性质及化学用语练习卷(解析版) 题型:选择题
下列说法正确的是( )。
A.丁达尔效应可以用来区别胶体和溶液
B.水银、水玻璃、胆矾都是纯净物
C.HCl、NH3、BaSO4都是电解质
D.H2、D2、T2属于同素异形体
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题6化学反应速率和化学平衡练习卷(解析版) 题型:选择题
一定条件下,在密闭容器中,能表示反应X(g)+2Y(g) 2Z(g)一定达到化学平衡状态的是 ( )。
2Z(g)一定达到化学平衡状态的是 ( )。
①X、Y、Z的物质的量之比为1∶2∶2 ②X、Y、Z的浓度不再发生变化 ③容器中的压强不再发生变化 ④单位时间内生成n mol Z,同时生成2n mol Y
A.①② B.①④ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题4物质结构与元素周期律练习卷(解析版) 题型:填空题
已知A、B、C、D分别是由短周期元素组成的四种微粒,它们之间有如图所示的转化关系,且A是一种含有18电子的微粒,C是一种含有10电子的微粒。请回答下列问题:

(1)若A、D分别是两种气态单质分子,写出A与B反应的化学方程式:_________________________________________________________________。
(2)若B、D属于同主族元素形成的单质分子,写出C的化学式:________。
(3)若A、B均是含有2个原子核的微粒,且B中含有10个电子,D中含有18个电子,则A、B之间发生反应的离子方程式为___________________________________________________。
(4)若D是一种含有22电子的分子,则符合如图所示转化关系的A为________________(写出物质的化学式,如果是有机物则写出相应的结构简式)。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题4物质结构与元素周期律练习卷(解析版) 题型:选择题
下列说法正确的是 ( )。
A.原子核都是由质子和中子构成的
B.同位素的化学性质基本相同,其物理性质不一定相同
C.第ⅠA族元素铯的两种同位素,137Cs比133Cs多4个质子
D.质子数相同的微粒都属于同种元素
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题3常见的两种重要反应类型练习卷(解析版) 题型:选择题
下列各组物质中只具有还原性的是 ( )。
A.F-、CO、Na B.Na、I-、Zn
C.Fe3+、SO42-、NO3- D.Fe3+、O2、H2O2
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题2常用化学计量-物质的量练习卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述错误的是 ( )。
A.标准状况下,22.4 L SO2和O2的混合气体中含有的氧原子数为2NA
B.标准状况下,22.4 L乙烯中含有共用电子对的数目为6NA
C.密闭容器中,3 mol H2和1 mol N2在高温、高压、催化剂的条件下充分反应后,容器内的气体分子总数为2NA
D.2.8 g的CO和2.8 g的N2所含质子数都为1.4NA
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题14物质结构与性质选考练习卷(解析版) 题型:填空题
下表为周期表的一部分,其中的编号代表对应的元素。

试填空。
(1)写出上表中元素I的基态原子的电子排布式和价层电子排布图:________________________________________________________________________。
元素C、D、E、F的第一电离能由大到小的顺序是________(用元素符号表示)。
(2)元素A分别与C、D、E形成最简单的常见化合物分子甲、乙和丙。下列有关叙述不正确的有________。
A.甲、乙和丙分子的空间构型分别为正四面体形、三角锥形、V形
B.甲、乙和丙分子中,中心原子均采取sp3的杂化方式
C.三种分子中键角由大到小的顺序是丙>乙>甲
D.甲、乙和丙分子均为由极性键构成的极性分子
(3)由元素J、C、E组成一种化学式为J(CE)5的配位化合物,该物质常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂。据此可判断:
①该化合物的晶体类型为________。
②该化合物的晶体中存在的作用力有________。
A.离子键 B.极性键
C.非极性键 D.范德华力
E.氢键 F.配位键
③根据共价键理论和等电子体理论分析,CE分子中σ键与π键的数目比为________。
(4)在测定A与F形成的化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是________________________________________________。
(5)某些不同族元素的性质也有一定的相似性,如表中元素G与元素B,原因是_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高一化学人教版必修二1-2-3元素周期表元素周期律应用练习卷(解析版) 题型:填空题
下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。
(1)把与下面元素有关性质相符的曲线标号填入相应的空格中:
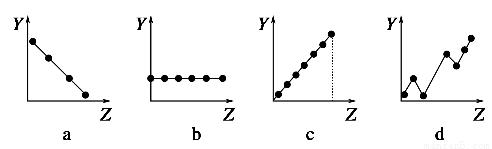
①第ⅡA族元素的价电子数________。
②第三周期元素的最高化合价________。
③F-、Na+、Mg2+、Al3+的离子半径________。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+的半径逐渐减小;化合物XN常温下为气体。据此回答:
①X为________(名称),Y为________(元素符号),Z原子结构示意图为________。
②N的最高价氧化物的水化物的化学式为__________。
③工业上制取单质M的化学方程式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com