


科目:高中化学 来源: 题型:阅读理解
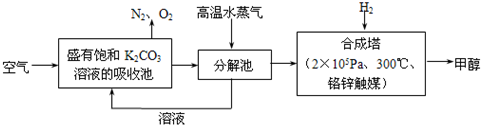
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体样品于试管中,滴加足量1moL?L-1 H2SO4至固体溶解,然后将内壁附有澄清石灰水的烧杯罩于试管口. | 若澄清石灰水未见浑浊,则假设1成立; 若澄清石灰水变浑浊,则 假设2或假设3成立 假设2或假设3成立 (或假设1不成立) (或假设1不成立) |
| 步骤2: | |
| 步骤3: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com