
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
 ,物质B是它的同分异构体,也含有苯环,那么物质B可能的结构有
,物质B是它的同分异构体,也含有苯环,那么物质B可能的结构有

查看答案和解析>>
科目:高中化学 来源: 题型:
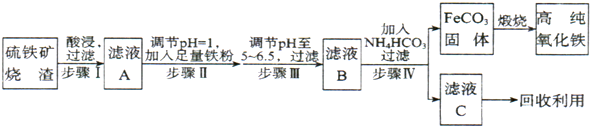
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:038
查看答案和解析>>
科目:高中化学 来源: 题型:038
某试剂厂生产的化学试剂FeCl3×6H2O,国家规定其二级品质量分数不低于99.0%,三级品质量分数不低于98.0%。现称取0.500g样品将其溶于水,向所得溶液中加少量盐酸使之酸化,并加入过量的KI溶液充分反应(2Fe3++2I-=2Fe2++I2),最后用0.100mol/L的Na2S2O3标准溶液滴定,Na2S2O3与I2反应的化学方程式为:I2+2Na2S2O3=2NaI+Na2S4O6,滴定达终点时用去Na2S2O318.17mL,试通过计算说明此样品属于哪一级产品?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com