
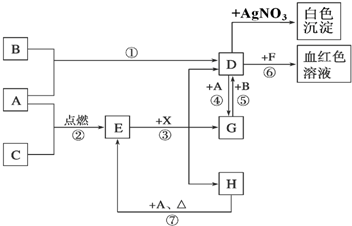
分析 A为固体,B为黄绿色气体,说明B为Cl2,D与F反应得到血红色溶液,结合转化关系可知,固体A为Fe,D为FeCl3,F为KSCN,由D与G之间的相互转化,可知G为FeCl2,Fe与无色气体C反应得到E,E与X反应得到D、G、H,且X常温下是无色气体,其水溶液是一种强酸,E为黑色固体,H在常温下为液体,可推知C为O2,E为Fe3O4,X为HCl,H为H2O,以此解答该题.
解答 解:A为固体,B为黄绿色气体,说明B为Cl2,D与F反应得到血红色溶液,结合转化关系可知,固体A为Fe,D为FeCl3,F为KSCN,由D与G之间的相互转化,可知G为FeCl2,Fe与无色气体C反应得到E,E与X反应得到D、G、H,且X常温下是无色气体,其水溶液是一种强酸,E为黑色固体,H在常温下为液体,可推知C为O2,E为Fe3O4,X为HCl,H为H2O,
(1)由上述分析可知,D为FeCl3,X为HCl,故答案为:FeCl3;HCl;
①反应③是HCl和Fe3O4发生的反应生成氯化铁、氯化亚铁和水,反应的离子方程式为:Fe3O4+8H+=2Fe3++Fe2++4H2O,
故答案为:Fe3O4+8H+=2Fe3++Fe2++4H2O;
②反应⑥是D为FeCl3和F为KSCN的反应,反应的离子方程式为:Fe3++3SCN-=Fe(SCN)3,
故答案为:Fe3++3SCN-=Fe(SCN)3;
③反应⑦的反应是铁在水蒸气中发生的反应生成四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2 ;
④反应⑤是G为FeCl2和B为Cl2反应生成氯化铁,反应的化学方程式为:2FeCl2+Cl2=2FeCl3,
故答案为:2FeCl2+Cl2=2FeCl3;
(2)反应①是氯气和铁反应生成氯化铁,属于氧化还原反应,
反应②为铁和氧气点燃反应生成四氧化三铁,属于氧化还原反应,
反应③是HCl和Fe3O4发生的反应生成氯化铁、氯化亚铁和水,不是氧化还原反应,
反应④是氯化铁和铁反应生成氯化亚铁属于氧化还原反应,
反应⑤是G为FeCl2和B为Cl2反应生成氯化铁,是氧化还原反应,
反应⑥是D为FeCl3和F为KSCN的反应,不是氧化还原反应,
反应⑦是铁在水蒸气中发生的反应生成四氧化三铁和氢气,属于氧化还原反应,
不属于氧化还原反应的是③⑥,
故答案为:③⑥.
点评 本题考查无机物推断,为高频考点,侧重于学生的分析能力的考查,涉及Fe、Cl元素化合物的性质与转化,物质的颜色是推断突破口,需要熟练掌握元素化合物知识,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢的五种同位素 | B. | 五种氢元素 | ||
| C. | 氢的五种原子 | D. | 氢元素的五种不同微粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸热88kJ | B. | 吸热2.44 kJ | C. | 放热44kJ | D. | 吸热44 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人们基于盐沸点较高的特性制作食物,如盐炯鸡等 | |
| B. | 基于醋的酸性,人们制作出了酪掩食品.如掩黄瓜、腌蒜等 | |
| C. | 碳酸饮料需低温保存是因为温度越低溶于水中的二氧化碳就越多 | |
| D. | 鱼腥味的罪魁祸首是鱼体内的碱性物质,做鱼时加入少量醋可发生中和反应清除异味. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
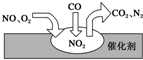 2012年中国汽车销量大幅增长,同时也带来了严重的空气污染.汽车尾气装置中,气体在催化剂表面吸附与解吸的过程如图所示,下列说法正确的是( )
2012年中国汽车销量大幅增长,同时也带来了严重的空气污染.汽车尾气装置中,气体在催化剂表面吸附与解吸的过程如图所示,下列说法正确的是( )| A. | 反应中NO为氧化剂,N2为氧化产物 | |
| B. | 汽车尾气的主要污染成分包括CO、NO和N2 | |
| C. | NO和O2必须在催化剂表面才能反应 | |
| D. | 催化转化总反应为2NO+O2+4CO$\frac{\underline{\;催化剂\;}}{\;}$4CO2+N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com