
【题目】常温下,用一定浓度的氨水滴定一定体积未知浓度的土壤浸出溶液,溶液的pH变化与滴入氨水体积的关系如图所示,下列有关说法不正确的是( )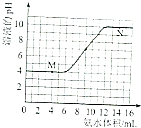
A.该土壤是酸性土壤
B.当溶液中c(H+)=c(OH﹣)时,消耗氨水的体积为9mL
C.M、N点由水电离出的氢离子浓度一定相等
D.将20mL此氨水与10mL同浓度的盐酸混合,充分反应后存在:C(NH4+)>c(Cl﹣)>c(NH3H2O)>c(OH﹣)>c(H+)
【答案】C
【解析】解:A.由图可知,该土壤浸出溶液pH=4,该土壤是酸性土壤,故A正确;
B.当溶液中c(H+)=c(OH﹣)时,即pH=7,根据图可知消耗氨水的体积为9mL,故B正确;
C.N点氨水过量,N点溶液中氢离子源于水的电离,M点溶液酸性可能是离子水解导致,也可能是酸电离导致,若为酸电离导致,M、N点由水电离出的氢离子浓度相等,若由离子水解导致,该情况下溶液中氢离子源于水的电离,M点由水电离出的氢离子浓度大于N点,故C错误;
D.将20mL此氨水与10mL同浓度的盐酸混合,得到等浓度的NH4Cl、NH3H2O混合溶液,一水合氨的电离程度大于铵根离子水解程度,溶液呈碱性,但弱电解质电离程度不大.,溶液中c(NH4+)>c(Cl﹣)>c(NH3H2O)>c(OH﹣)>c(H+),故D正确.
故选:C.
A.由图可知,该土壤浸出溶液pH=4; B.当溶液中c(H+)=c(OH﹣)时,即pH=7,根据图可知消耗氨水的体积; C.M点溶液酸性可能是离子水解导致,也可能是酸电离导致,N点氨水过量,N点溶液中氢离子源于水的电离; D.将20mL此氨水与10mL同浓度的盐酸混合,得到等浓度的NH4Cl、NH3H2O混合溶液,一水合氨的电离程度大于铵根离子水解程度,溶液呈碱性,但弱电解质电离程度不大.


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】在密闭容器中通入物质的量浓度均为0.1的CH4与CO2 , 在一定条件下发生反应CH4(g)+CO2(g)2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图所示.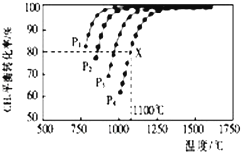
(1)据图可知,p1、p2、p3、p4由大到小的顺序是;
(2)在压强为p4、1100°C的条件下,该反应5min时达到平衡X点,反应的平衡常数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 g镁、锌、铁的混合物与一定量的10%的稀硫酸恰好完全反应,将反应后的混合溶液蒸干后可得不含结晶水的固体146 g,则反应生成氢气的质量为
A. 1 g B. 2 g C. 3 g D. 4 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸在工业及科研上常用于物质的制备.实验室常用稀硝酸与铜反应制取干燥且较纯的一氧化氮,现设计如下实验.按下图连接好装置并检查气密性,在A中加入0.5g碳酸钙粉末,再加入20.0mL 5.0molL﹣1的稀硝酸,片刻后塞上胶塞,将铜丝插入稀硝酸中. 
(1)从图2中选择合适的装置接入图1虚线框中,则a接、接b (填连接的字母).
(2)当观察到 . 现象时,表明NO已收集满,立即将铜丝抽离液面.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的铁粉加入到一定量的硝酸银和硝酸镁的混合液中,充分反应后过滤,向滤渣中加入稀硫酸,有气泡产生,则在滤渣中
A.一定有银、铁和镁 B.仅有银和铁
C.可能含镁 D.只有银
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分为氧化铝、氧化铁和二氧化硅,工业上经过下列工艺可以冶炼金属铝:下列说法中错误的是( ) ![]()
A.①②中除加试剂外,还需要进行过滤操作
B.a、b中铝元素的化合价不相同
C.③中需要通入过量的CO2
D.④进行的操作是加热,而且d一定是氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列几个离子反应:( )
① Cr2O ![]() +14H++6Cl-=2Cr3++3Cl2↑+7H2O
+14H++6Cl-=2Cr3++3Cl2↑+7H2O
② 2Fe2++Br2=2Fe3++2Br-③ 2Br-+Cl2= Br2+2Cl-
④2Fe3++SO2+2H2O=2Fe2++SO ![]() +4H+
+4H+
下列有关性质的比较中正确的是( )。
A.氧化性:Cr2O72->Cl2>Fe3+
B.氧化性:Cl2>Br2>Cr2O72-
C.还原性:SO2<Fe2+<Br-
D.还原性:Cl->Cr3+>Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据你已有的知识和经验,分析下列过程的焓变、熵变,并判断反应的方向.
(1)H+(aq)+OH﹣(aq)=H2O (l)△S=+80.7Jmol﹣1K﹣1 , △H0,△S0,该反应(自发或非自发)
(2)TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g)△H=+161.9kJmol﹣1,△S=﹣38.4Jmol﹣1K﹣1该反应(自发或非自发)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com