
【题目】按要求回答下列问题:
(1)甲基的电子式为________,0.5 mol甲基中含有_____mol电子。
(2)丙烷的结构简式为________,该物质常温下为______(填“气态”“液态”或“固态”)。
(3)分子中含30个氢原子的烷烃的分子式为________。
【答案】![]() 4.5 CH3CH2CH3 气态 C14H30
4.5 CH3CH2CH3 气态 C14H30
【解析】
(1)甲基是甲烷分子去一个氢原子得到的原子团,据此回答;
(2)丙烷是气体,分子式为C3H8,据此回答;
(3)烷烃的通式为CnH2n+2,据此回答。
(1) 甲基是甲烷分子去一个氢原子得到的原子团,电子式为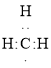 , 0.5 mol甲基中含有0.5 mol×9=4.5mol电子;
, 0.5 mol甲基中含有0.5 mol×9=4.5mol电子;
答案为: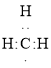 ; 4.5 ;
; 4.5 ;
(2)丙烷的C3H8,则结构简式为CH3CH2CH3,分子内碳原子在1到4的烃在常温下为气态,丙烷室温下呈气态;
答案为:CH3CH2CH3;气态;
(3)烷烃的通式为CnH2n+2,分子中含30个氢原子,则n=14,则烷烃的分子式为C14H30;
答案为:C14H30。


科目:高中化学 来源: 题型:
【题目】[化学一选修3:物质结构与性质]
金属材料在国民经济建设等领域具有重要应用,镁、镍、铜是几种重要的金属元素,请回答下列问题:
(1)镍元素的核电荷数为28,则原子基态电子排布式为 ________ ,结构中有 ___ 种不同形状的电子云。
(2)MgO的熔点高于CuO的原因是__________________________
(3)Mg元素的第一电离能反常地高于同周期后一种元素,原因是_____________________
(4)Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为 _____________________
(5)配合物[Cu(CH3C≡N)4]BF4中碳原子杂化轨道类型为______ ,BF4-的空间构型为_________________ 。
(6)铜与氧元素可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(1/2,1/2,1/2),则d的坐标参数为 ____________,已知该品体的密度为ρg/cm3,NA是阿伏加德罗常数值,则晶胞参数为 _______________ cm(列出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、300℃时,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应:X(g)+Y(g)2Z(g)ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
(1)反应0~2minZ的平均速率v(Z)=____
(2)能判断该反应已经达到平衡状态的是____
A.生成X的速率是生成Z的速率的2倍 B.容器内压强保持不变
C.容器内气体的密度保持不变 D.容器内各气体的浓度保持不变
(3)温度为300℃时,该反应的化学平衡常数K= ___
II、(1)常温下,0.005mol·L-1Ba(OH)2溶液的pH=_____
(2)常温下,向0.1mol·L-1NH3·H2O溶液中不断加水,过程中c(OH-)/c(NH3·H2O)将____(选填“增大”、“减小”或“不变”)
(3)下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)
Fe3+ | Al3+ | Zn2+ | |
开始沉淀的pH | 1.1 | 3.2 | 5.9 |
完全沉淀的pH | 3.2 | 5 | 8.9 |
某溶液中含Fe3+、Al3+、Zn2+,欲除去Fe3+、Al3+,向其中滴加1.0moL·L-1的NaOH溶液调节溶液的pH为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的结构简式为![]() ,它可能具有的性质是
,它可能具有的性质是
A. 它能使溴水褪色,但不能使酸性高锰酸钾溶液褪色
B. 它既能使溴水褪色,也能使酸性高锰酸钾溶液褪色
C. 易溶于水,也易溶于有机溶剂
D. 能发生加成反应,一定条件下最多可与三倍物质的量的氢气加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质,粗盐精制的实验流程如下。下列说法不正确的是( )
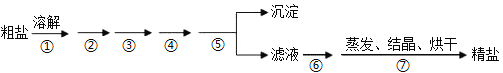
A.在第①步中使用玻璃棒搅拌可加速粗盐溶解
B.第⑤步操作是过滤
C.在第②③④⑥步通过加入化学试剂除杂,加入试剂顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→稀盐酸
D.除去MgCl2的化学方程式为:MgCl2 + 2NaOH =Mg(OH)2↓+ 2NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备丙烯的方法有多种,具体如下(本题丙烯用C3H6表示):
(1)丙烷(C3H8)脱氢制备丙烯(C3H6)
由下图可得,C3H8(g)![]() C3H6(g)+H2(g),△H=_________kJ/.mol
C3H6(g)+H2(g),△H=_________kJ/.mol

(2)用惰性电极电解CO2的酸性溶液可得丙烯(C3H6),其原理如下图所示。则b的电极反应式为__________。

(3)以丁烯(C4H8)和乙烯(C2H4)为原料反应生成丙烯(C3H6)的方法被称为“烯歧化法”,反应为:C4H8(g)+C2H4(g)![]() 2C3H6(g) △H>0
2C3H6(g) △H>0
一定温度下,在一体积恒为VL的密闭容器中充入一定量的C4H8和C2H4,发生烯烃歧化反应。
I.该反应达到平衡的标志是______________
a.反应速率满足:2v生成(C4H8)=v生成(C3H6)
b.C4H8、C2H4、C3H6的物质的量之比为1:1:2
c.混合气体的平均相对分子质量不再改变
d.C4H8、C2H4、C3H6的浓度均不再变化
Ⅱ.已知t1min时达到平衡状态,测得此时容器中n(C4H8)=mmol,n(C2H4)=2mmol,n(C3H6)=nmol,且平衡时C3H6的体积分数为![]() 。
。
①该时间段内的反应速率v(C4H8)= _______mol/(L·min)。(用只含m、V、t1的式子表示)。
②此反应的平衡常数K=______________。
③t1min时再往容器内通入等物质的量的C4H8和C2H4,在新平衡中C3H6的体积分数_______![]() (填“>”“<”“=”)。
(填“>”“<”“=”)。
(4)“丁烯裂解法”是另一种生产丙烯的方法,但生产过程中伴有生成乙烯的副反应发生,具体反应如下:主反应:3C4H8![]() 4C3H6;副反应:C4H8
4C3H6;副反应:C4H8![]() 2C2H4
2C2H4
①从产物的纯度考虑,丙烯和乙烯的质量比越高越好。则从下表现的趋势来看,下列反应条件最适宜的是__________(填字母序号)。
a.300℃0.1MPa b.700℃0.1MPa c.300℃0.5MPa d.700℃0.5MPa
②下图中,平衡体系中丙烯的百分含量随压强增大呈上升趋势,从平衡角度解释其可能的原因是_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以两种烃为主要原料合成香料M的路线如下:
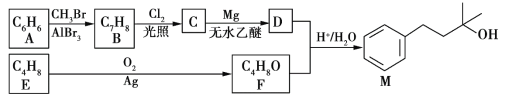
已知:①A分子只有一种氢原子。E能使酸性高锰酸钾溶液褪色,与HBr发生反应可得到2种产物。
②RX![]() R-MgX(X为卤原子)
R-MgX(X为卤原子) ![]() RCH2CH2OMgX
RCH2CH2OMgX![]() RCH2CH2OH
RCH2CH2OH
回答下列问题:
(1)C中官能团名称是__________________;E的名称是__________________。
(2)F的结构简式为__________________;B→C的反应类型是__________________。
(3)写出A→B的化学方程式:____________________________________。
(4)在F的单官能团同分异构体中,除环醚外,还有____________种。其中,在核磁共振氢谱上有3个峰且峰的面积比为1∶1∶6的结构简式为__________________。
(5)写出鉴别A、B两种有机物可选用的化学试剂__________________。
(6)以苯和环氧乙烷(![]() )为原料制备苯乙醇,设计不超过4步的合成路线_________________(无机试剂任选)。
)为原料制备苯乙醇,设计不超过4步的合成路线_________________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及其化合物广泛应用于金属冶炼、有机合成等领域。
⑴铝热反应可以冶炼金属铬,Cr基态核外电子排布式为_______。
⑵已知反应:

①乙酸酐分子中碳原子轨道的杂化类型为______。
②1 mol对甲基苯乙酮分子中含有的σ键的数目为_____。
③甲苯分子难溶于水的原因是______。
④单个AlCl3气态分子的空间构型为______,AlCl3可与Cl-形成AlCl![]() ,与AlCl
,与AlCl![]() 互为等电子体的分子为______。
互为等电子体的分子为______。
(3)某遮光剂的晶胞如右图所示,则n=______。
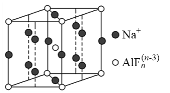
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A经李比希法和质谱法分析得知其分子式是C8H8O2,相对分子质量136。A的核磁共振氢谱有4个峰,峰面积之比为1:2:2:3,A分子中只含一个苯环且苯环上只有1个取代基,其核磁共振氢谱与红外光谱如下图。
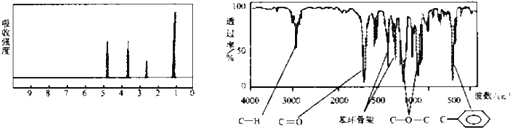
请回答下列问题。
(1)A的结构简式是________。
(2)A的同分异构体(不含A)中属于酯类的芳香族化合物共有___种,请写出其中任意两种的结构简式_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com