
����Ŀ����ѧ���������ǻ�ѧ֪ʶ����Ҫ��ɲ�����
��1���������������� ������������������ ���������⼸�����ʸ����У��뻯ѧ�仯�й�������__________��
��2���ڢ���ˮ������ˮ����п����ˮ����������ˮ�⼸������ˮ����ص����ʸ����У���ʾ���������_____(��д���)
��3�����������ǻ�ѧ��������֮һ��ʵ����ͨ���������ˮ����μ���________�ķ������Ʊ�Fe(OH)3���壬����Fe(OH)3����Ļ�ѧ����ʽ�ɱ�ʾΪ____________���������Ƶõ�Fe(OH)3��������μ���ϡ���������������Թ۲쵽��������____________��
��4����������ԭ��������Ӧ��������Ҳ�ǻ�ѧ�г��õĻ�������ظ����(K2Cr2O7)��һ�ֱȽ�ǿ������������������ˮ��Һ�ڳ��¼����Խ�������˫��ˮ����Ʊ���ɫ��̬CrO5�ķ�Ӧȴ��һ����������ԭ��Ӧ����д���÷�Ӧ�����ӷ���ʽ______________��CrO5�������ǹ�����������ÿ��CrO5�ķ����к��еĹ�������ĿΪ_______________
���𰸡� ���� �� FeCl3������Һ FeCl3+3H2O![]() Fe(OH)3 (����)+3HCl �ȳ��ֺ��ɫ������������ܽ� Cr2O72-+4H2O2+2H-=2CrO5��+5H2O 2
Fe(OH)3 (����)+3HCl �ȳ��ֺ��ɫ������������ܽ� Cr2O72-+4H2O2+2H-=2CrO5��+5H2O 2
��������������Ҫ����������
��1���������������� ������������������ ���������⼸�����ʸ����У��������ֽⷴӦ�ȣ������뻯ѧ�仯�й������Ǹ�����
��2���ڢ���ˮ������ˮ����п����ˮ����������ˮ�⼸������ˮ����ص����ʸ����У��٢ۢ�����Һ��������Ա�ʾ��������Ǣڡ�
��3������Fe(OH)3����Ļ�ѧ����ʽ�ɱ�ʾΪFeCl3+3H2O![]() Fe(OH)3(����)+3HCl���������Ƶõ�Fe(OH)3��������μ���ϡ����������������ϡ������Ϊ�������Һʹ�������ۣ�Ȼ��ϡ������Ϊ����Һ�������������������кͷ�Ӧ�������Ȼ�����Һ�����Կ��Թ۲쵽���������ȳ��ֺ��ɫ������������ܽ���
Fe(OH)3(����)+3HCl���������Ƶõ�Fe(OH)3��������μ���ϡ����������������ϡ������Ϊ�������Һʹ�������ۣ�Ȼ��ϡ������Ϊ����Һ�������������������кͷ�Ӧ�������Ȼ�����Һ�����Կ��Թ۲쵽���������ȳ��ֺ��ɫ������������ܽ���
��4��CrO5������Cr�Ļ��ϼ�+6��Ϊ�����㻯�ϼ۴�����Ϊ�㣬��ÿ��CrO5�ķ����к��еĹ�������ĿΪ2��


 �¿α�ͬ��ѵ��ϵ�д�
�¿α�ͬ��ѵ��ϵ�д� һ����ʦ����Ӧ����������һ��ȫϵ�д�
һ����ʦ����Ӧ����������һ��ȫϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������10 mL 0.1 mol��L��1NaOH��Һ�м���0.1 mol��L��1��һԪ��HA����ҺpH�ı仯������ͼ��ʾ������˵����ȷ����(����)
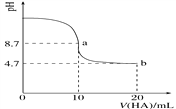
A. a����ʾ��Һ��c(Na��)>c(A��)>c(H��)>c(HA)
B. a��b������ʾ��Һ��ˮ�ĵ���̶���ͬ
C. pH��7ʱ��c(Na��)��c(A��)��c(HA)
D. b����ʾ��Һ��c(A��)>c(HA)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ע�����м�������Na2SO3���壬����������Ũ���ᣨ�Բ��Ӵ�ֽ��Ϊ�����������й�˵����ȷ���ǣ� �� 
A.ʪ����۵⻯����ֽδ����˵����Ԫ�صķǽ�����ǿ�ڵ�Ԫ��
B.մ��KMnO4��Һ����ֽ��ɫ֤����SO2����Ư����
C.ʵ��ɰ�ע�����е����ʻ�������NaOH��Һ�У��Լ��ٻ�����Ⱦ
D.��ɫʯ����ֽ���˵��SO2����ˮ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������;�㷺�Ļ���ԭ�ϣ�������ˮ������ˮ�����������ʹ����ȣ�
��1����ϡ���ᡢͭ����������ȡ����ͭ����������Ҫ��������ͼ��ʾ�� 
ϡ���ᡢͭ����������Ӧ����������������ԭ��Ӧ�����ӷ���ʽ����������Һ��ͨ���ȿ����ķ�Ӧ�����ӷ���ʽ��������Һ�õ���ˮ����ͭ��ʵ������� ��
��2���������������������Ṥҵβ���еĶ�������ͬʱ�Ƶ�����泥���Ҫ�Ĺ�����������ͼ��ʾ�� 
���������з�����Ӧ�Ļ�ѧ����ʽ�� ��
�������ݱ���������������Һ��pH��5.5��6.0֮�䣬����Ч�ʽϸߣ�������һ��������β��ʱ��������Һ��pH�ķ����� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Һ���У�����ˮ�л���ֲַ������ڵ����ȵ�����������Һ��ʱ�ֲ����������ʧ���ǣ� ��
A.��B.����C.������D.����ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ����У������ɽ���������ֱ�ӷ�Ӧ�Ƶã������ɽ��������ᷴӦ�Ƶõ���()
A. CuCl2 B. FeCl2 C. FeCl3 D. MgCl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���һ�����pH��12��Ba(OH)2��Һ�У���μ���һ�����ʵ���Ũ�ȵ�NaHSO4��Һ������Һ�е�Ba2��ǡ����ȫ����ʱ����Һ��pH��11������Ӧ����Һ���������Ba(OH)2��Һ��NaHSO4��Һ�����֮�ͣ���Ba(OH)2��Һ��NaHSO4��Һ���������
A. 1��9 B. 1��1 C. 1��2 D. 1��4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ�����ر�Kʱ����A �г���2molX��7molY����B�г���4molX��14molY����ʼʱVA=VB= a��������ͬ�¶Ⱥ��д������ڵ������£����������Է������з�Ӧ��2X��g��+2Y��g�� Z��g��+2W��g����H��0 ���ﵽƽ����ʱVB = 0.9a�����Իش�

��1��A��W��B��Z�����ʵ����� n��W��A_______ n��Z��B �����������
��2��B��X ��ת��������X����_____________
��3����K����һ��ʱ�����´�ƽ����ʱ��B�����Ϊ_____________-�������ú�a�Ĵ���ʽ��ʾ����ͨ��������������ƣ�[д����2������3���ļ������]
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(Si3N4)��һ�������մɲ��ϣ�������ʯӢ�뽹̿�ڸ��µĵ������У�ͨ�����·�Ӧ�Ƶã�3SiO2(s)+6C(s)+ 2N2(g) ![]() Si3N4(s) + 6CO(g)
Si3N4(s) + 6CO(g)
��1��2molN2�μӷ�Ӧת�Ƶ�����Ϊ_________��
��2���ﵽƽ��ı�ijһ������������ı�N2��CO����������Ӧ����v�� ʱ��t�Ĺ�ϵ��ͼ��ͼ��t4ʱ����ƽ���ƶ�������������______________________��ͼ�б�ʾƽ��������CO�ĺ�����ߵ�һ��ʱ����____________��
��3�����÷�Ӧ��ƽ�ⳣ��Ϊ K��729������ͬ�¶���1L�ܱ������У�������SiO2��C��2mol N2��ַ�Ӧ����N2��ת������__________________ (��ʾ��272 = 729)��

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com