
| A. | 稀醋酸中加入少量醋酸钠固体减小醋酸的电离程度 | |
| B. | 0.02 mol•L-1HCl溶液与0.02 mol•L-1Ba(OH)2溶液等体积混合后,溶液pH约为12 | |
| C. | 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 | |
| D. | pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 |
分析 A.醋酸溶液中存在电离平衡电离出醋酸根离子和氢离子,加入醋酸钠固体,溶解后醋酸根离子浓度增大;
B.0.02 mol•L-1HCl溶液与0.02 mol•L-1Ba(OH)2溶液等体积混合后,依据酸溶液中氢离子物质的量和碱溶液中氢氧根离子物质的量比较克制氢氧根离子过量,计算混合溶液中剩余氢氧根离子浓度,结合离子积常数计算氢离子浓度得到溶液PH;
C.醋酸的浓度越大,其电离程度越小;
D.pH=11的NaOH溶液中c(NaOH)=0.001mol/L,pH=3的醋酸溶液中c(CH3COOH)>0.001mol/L,等体积混合,酸剩余.
解答 解:A.醋酸溶液中存在电离平衡电离出醋酸根离子和氢离子,CH3COOH?CH3COO-+H+,加入醋酸钠固体,溶解后醋酸根离子浓度增大,电离平衡逆向进行,稀醋酸中加入少量醋酸钠固体减小醋酸的电离程度,故A正确;
B.0.02 mol•L-1HCl溶液与0.02 mol•L-1Ba(OH)2溶液等体积混合后剩余氢氧根离子浓度,(OH-)=$\frac{0.02mol/L×VL×2-0.02mol/L×V}{2V}$=0.01 mol•L-1,c(H+)=$\frac{1{0}^{-14}}{0.01}$=10-12mol/L,则pH等于12,故B正确;
C.醋酸的浓度越大其电离程度越小,所以两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1>10c2,故C错误;
D.pH=11的NaOH溶液中c(NaOH)=0.001mol/L,pH=3的醋酸溶液中c(CH3COOH)>0.001mol/L,等体积混合,酸剩余,溶液呈酸性,酸能使石蕊试液呈红色,故D正确;
故选C.
点评 本题考查了酸碱混合溶液定性判断,根据电荷守恒、弱电解质电离平衡的影响因素等知识来分析解答,易错选项是C,注意弱电解质电离程度与溶液浓度的关系,为易错点,题目难度中等.


 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{6}^{14}$C和${\;}_{6}^{12}$C是同一种核素 | |
| B. | 红磷和白磷互为同素异形体 | |
| C. | CH3COOCH2CH3和CH3CH2COOCH3是不同物质 | |
| D. | CH3CH2OH可看成是由-C2H5和-OH组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸的电离方程式为:HClO═H++ClO- | |
| B. | c(H+)等于1×10-7mol•L-1的溶液一定是中性溶液 | |
| C. | 在CH3COONa溶液中,c(CH3COO-)<c(Na+) | |
| D. | 0.2mol•L-1CH3COOH溶液中的c(H+)是0.1mol•L-1 HCl溶液中的c(H+)的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同温度时,100mL0.01mol/L的醋酸溶液与10mL0.1mol/L的醋酸溶液相比较,H+的物质的量前者等于后者 | |
| B. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3KJ/mol,若将含1mol CH3COOH的稀溶液与含1molNaOH的稀溶液混合,放出的热量小于57.3KJ | |
| C. | 反应2Mg(s)+CO2(g)═C(s)+2MgO(s)能自发进行,则该反应的△H>0 | |
| D. | N2(g)+3H2(g)═2NH3(g)△H<0.其他条件不变时升高温度,反应速率和氢气的平衡转化率均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

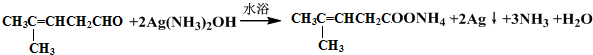
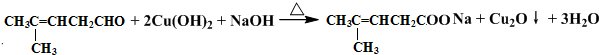 ;然后往反应后的溶液中加入稀硫酸至溶液呈酸性,再滴加足量的溴水,检验分子中碳碳双键,生成的有机产物的结构简式是
;然后往反应后的溶液中加入稀硫酸至溶液呈酸性,再滴加足量的溴水,检验分子中碳碳双键,生成的有机产物的结构简式是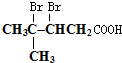 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐、淡水 | B. | 氯、溴、碘 | C. | 钠、镁、铝 | D. | 烧碱、氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol 氢气和1 mol碘蒸气完全反应需要吸收26 kJ的热量 | |
| B. | 1个氢分子和1个碘分子完全反应需要吸收52 kJ的热量 | |
| C. | 1 mol H2(g)与1 mol I2(g)完全反应生成 2 mol的HI气体需吸收52 kJ的热量 | |
| D. | 1 mol H2(g)与1 mol I2(g)完全反应放出26 kJ的热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com