
【题目】请按要求回答下列问题:
(1)下列物质:①HCl ②NaOH ③Cl2 ④H2O ⑤NH4Cl ⑥MgCl2 ⑦CaO ⑧CO2,其中只存在离子键的是:_________(用序号回答,下同。);既存在离子键又存在共价键的是:_________;试写出⑧的电子式:__________。
(2)在下列物质中,互为同分异构体的是_________(填序号,下同。);互为同素异形体的是_________;互为同系物的是_________;互为同位素的是_________;为同一物质的是_________。
①液氨和氨气 ②NH4CNO和CO(NH2)2 ③4019K和4020Ca ④白磷和红磷 ⑤35Cl和37Cl ⑥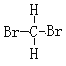 和
和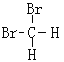 ⑦CH3CH3 和
⑦CH3CH3 和![]() ⑧CH4和 CH2=CH-CH3 ⑨CH2=CH-CH3 和
⑧CH4和 CH2=CH-CH3 ⑨CH2=CH-CH3 和![]()
【答案】⑥⑦ ②⑤ ![]() ②⑨ ④ ⑦ ⑤ ①⑥
②⑨ ④ ⑦ ⑤ ①⑥
【解析】
(1)一般情况下,非金属元素的原子间形成共价键,金属与非金属元素形成离子键,离子键存在于离子化合物中,复杂的离子化合物中含有离子键、共价键;共价化合物只含有共价键,然后结合具体物质分析、判断;
(2)同分异构体是分子式相同,结构不同的化合物;
同素异形体是由同种元素组成的不同性质的单质;
同系物是结构相似,在分子组成上相差1个或若干个CH2原子团的化合物;
同位素是质子数相同,中子数不同的原子;
同一物质分子式相同,物质结构相同,化学性质相同,物理性质可能相同,也可能不同的物质。据此分析解答。
①HCl 是共价化合物,只含有极性共价键;
②NaOH 是离子化合物,含有离子键、极性共价键;
③Cl2是非金属单质,只存在非极性共价键;
④H2O是共价化合物,只含有极性共价键;
⑤NH4Cl是离子化合物,含有离子键、极性共价键;
⑥MgCl2是离子化合物,只含有离子键;
⑦CaO是离子化合物,只含有离子键;
⑧CO2 是共价化合物,只含有极性共价键;
则上述物质中只存在离子键的是⑥⑦;既存在离子键又存在共价键的是②⑤;⑧是CO2,C原子最外层有4个电子,与2个O原子形成4对共用电子对,使每个原子都达到稳定结构,所以CO2的电子式为:![]() 。
。
(2)①液氨和氨气分子式都是NH3,是同一物质的不同的存在状态;
②NH4CNO和CO(NH2)2是分子式相同,结构不同的化合物,属于同分异构体;
③4019K和4020Ca质子数不同,中子数也不同,不是同位素;
④白磷和红磷是由同种元素组成的不同性质的单质,属于同素异形体;
⑤35Cl和37Cl质子数都是17,中子数不同,属于同位素;
⑥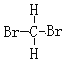 和
和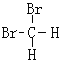 是甲烷分子中的2个H原子被Br原子取代产生的物质,由于甲烷是正四面体结构,任何两个化学键都相邻,因此二者是同一物质;
是甲烷分子中的2个H原子被Br原子取代产生的物质,由于甲烷是正四面体结构,任何两个化学键都相邻,因此二者是同一物质;
⑦CH3CH3 和![]() 是结构相似,在分子组成上相差3个CH2原子团的化合物,属于同系物;
是结构相似,在分子组成上相差3个CH2原子团的化合物,属于同系物;
⑧CH4和CH2=CH-CH3 结构不相似,不属于同系物,分子式不同,不是同分异构体;⑨CH2=CH-CH3 和![]() 是分子式相同,结构不同的化合物,属于同分异构体;
是分子式相同,结构不同的化合物,属于同分异构体;
故上述物质中,互为同分异构体的是②⑨;互为同素异形体的是④;互为同系物的是⑦;互为同位素的是⑤;为同一物质的是①⑥。


科目:高中化学 来源: 题型:
【题目】在一定温度下,将一定量的气体通入体积为2 L的密闭容器中,使其发生反应,有关物质X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是( )

A. 该反应的化学方程式为:3Z![]() 2X+3Y
2X+3Y
B. t0时,反应停止,反应速率为0
C. t0时,Z的浓度为1.2 mol/L
D. t0时,X、Y、Z的质量不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将含有C.H、O的有机物3.24 g,装入元素分析装置,通入足量的O2使它完全燃烧,将生成的气体依次通过氯化钙干燥管A和碱石灰干燥管B。测得A管质量增加了2.16g,B管增加了9.24g。已知该有机物的相对分子质量为108。
(1)燃烧此化合物3.24g,须消耗氧气的质量是多少______?
(2)求此化合物的分子式______?(要有简单计算过程)
(3)该化合物1分子中存在1个苯环和1个羟基,试写出它的同分异构体的结构简式______。(计算要有文字说明过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F(C11H12O2)属于芳香酯类物质,可由下列路线合成:
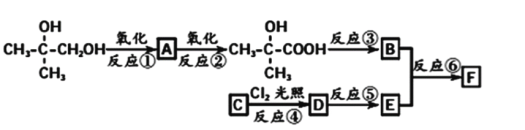
已知:B在一定条件下可发生加聚反应形成高分子化合物
回答下列问题:
(1)A中官能团的名称是____________,上述③④⑤⑥反应中属于取代反应的有_____(填相应序号)
(2)反应③的条件是___________________。
(3)写出B发生加聚反应形成高分子化合物的化学方程式____________________。
(4)反应⑥的化学方程式是__________________________________
(5)A、B、E三种有机物,可用下列的某一种试剂鉴别,该试剂是______.
a.新制的Cu(OH)2悬浊液 b.溴水 c.酸性KMnO4溶液 d.溴的CCl4溶液
(6)G是E的同系物且相对分子质量比E大28.G有多种同分异构体,其中符合下列条件的同分异构体有_____种①能与Na2CO3溶液反应 ②分子中含有两个-CH3.其中核磁共振氢谱有5组峰,且面积比为6:1:2:2:1的结构简式____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
(1)在2L密闭容器内,800℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
①如图中,表示NO2变化曲线的是_______ 。用O2表示从0s ~2s内该反应的平均速率V=__________。
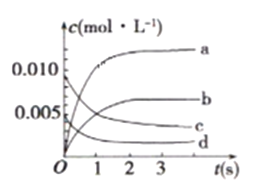
②能说明该反应已达到平衡状态的是___________
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.容器中氧气体积分数不变 D.容器内密度保持不变
(2)为了探究铝电极在原电池中的作用,设计并进行了以下一系列实验,试完成有关问题:
实验编号 | 电极材料 | 电解质溶液 |
1 | Al、Mg | 稀盐酸 |
2 | Al、Cu | 稀盐酸 |
3 | Al、C(石墨) | 稀盐酸 |
4 | Al、 | 氢氧化钠溶液 |
5 | Al、Zn | 浓硝酸 |
①实验1中Al所作的电极是______(填“正极”或“负极”)。
②实验2中H+移向______(填“Al”或“Cu”),Cu极发生_____反应(填“氧化”或“还原”)。
③实验3中石墨的电极反应式: _________________。
④实验4中铝作______极,写出总反应的化学方程式:_______________________。
⑤实验5中负极的电极反应式为:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,又是一种重要的化工原料.具有广阔的开发和应用前景。工业上可用如下方法合成甲醇:CO(g)+2H2(g)![]() CH3OH(g).
CH3OH(g).
(1) 已知:①2CH3OH(l)+3O2(g)![]() 2CO2(g)+4H2O(g)△H=-1275.6kJ·mol-1;
2CO2(g)+4H2O(g)△H=-1275.6kJ·mol-1;
②2CO(g)+O2(g)![]() 2CO2(g)△H=-566.0kJ·mol-1;
2CO2(g)△H=-566.0kJ·mol-1;
③H2O(l)=H2O(g)△H=+44.0kJ·mol-1.
则甲醇液体不完全燃烧生成CO和液态水的热化学方程式为__________。
(2) 在一定温度下,向2L密闭容器中充人1mol CO和2mol H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),5min反应达到平衡,此时CO的转化率为80%。
CH3OH(g),5min反应达到平衡,此时CO的转化率为80%。
①前5min内甲醇的平均反应速率为__________;已知该反应在低温下能自发进行,则反应的△H_______0(填“>”“<”或“=”)。
②在该温度下反应的平衡常数K=__________。
③某时刻向该平衡体系中加人CO、H2、CH3OH各0.2mol后,则v正__________v逆(填“>”“=”或“<”)。
④当反应达到平衡时,__________(填字母)。
a.混合气体的压强不再发生变化 b.反应物不再转化为生成物
c.v正(CO)=2v逆(H2) d.v(H2)=2v(CH3OH)
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
(3) "甲醇---过氧化氢燃料电池"的结构主要包括燃料腔、 氧化剂腔和质子交换膜三部分.放电过程中其中一个腔中生成了CO2。
①放电过程中生成H+的反应,发生在__________腔中,该腔中的电极反应式为__________.
②该电池工作过程中,当消耗甲醇4.8g时.电路中通过的电量为__________(法拉第常数F=9.65×104C·mol-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上由N2、H2合成NH3。制备H2需经多步完成,其中“水煤气(CO、H2)变换”是纯化H2的关键一步。
(1)水煤气变换:CO(g)+ H2O(g)![]() CO2(g) + H2(g),该反应的H = +41 kJ/mol或﹣41 kJ/mol。
CO2(g) + H2(g),该反应的H = +41 kJ/mol或﹣41 kJ/mol。
① 平衡常数K随温度变化如下:
温度/℃ | 200 | 300 | 400 |
K | 290 | 39 | 11.7 |
下列分析正确的是__________。
a. 水煤气变换反应的H<0
b. 增大压强,可以提高CO的平衡转化率
c. 增大水蒸气浓度,可以同时增大CO的平衡转化率和反应速率
② 温度为T1时,向容积为2 L 的密闭容器甲、乙中分别充入一定量的CO和H2O(g),
相关数据如下:
容器 | 甲 | 乙 | ||
反应物 | CO | H2O | CO | H2O |
起始时物质的量(mol) | 1.2 | 0.6 | 2.4 | 1.2 |
平衡时物质的量(mol) | 0.8 | 0.2 | a | b |
达到平衡的时间(min) | t 1 | t 2 | ||
ⅰ. 甲容器中,反应在t1 min 内的平均反应速率v(H2)=_____mol/(L·min)。
ⅱ. 甲容器中,平衡时,反应的热量变化为_____kJ。
ⅲ. T1时,反应的平衡常数K甲= ______。
ⅳ. 乙容器中,a =______mol。
(2)以氨水为吸收剂脱除CO2。当其失去吸收能力时,通过加热使吸收剂再生。用化学方程式表示“吸收”过程:___________________________________。
(3)2016年我国某科研团队利用透氧膜,一步即获得N2、H2,工作原理如图所示。(空气中N2与O2的物质的量之比按4:1计)。
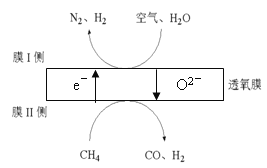
① 起还原作用的物质是_______。
② 膜Ⅰ侧发生的电极反应式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中甲为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,乙为电解饱和MgCl2溶液的装置,其中乙装置中X为阳离子交换膜。用该装置进行实验,反应开始后观察到Fe电极附近出现白色沉淀。下列说法正确的是
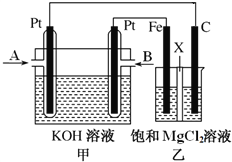
A. 甲中A处通入CH4,电极反应式为CH4+10OH--8e-=== ![]() +7H2O
+7H2O
B. 乙中电解MgCl2溶液的总反应为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C. 理论上甲中每消耗22.4 L CH4(标准状况下),乙中产生4 mol Cl2
D. 甲、乙中电解质溶液的pH都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铯137是金属铯的同位素之一,与“铀235”同属于放射性物质。下列对![]() 与
与![]() 描述正确的是( )
描述正确的是( )
A. Cs与U的质子数差值为37
B. Cs与U的中子数差值为98
C. 铯137的电子数是82
D. 铀元素的相对原子质量是235
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com