
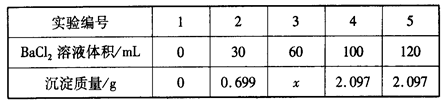
向60 mL Na2SO4溶液中加入BaCl2溶液,有关数据见下表:
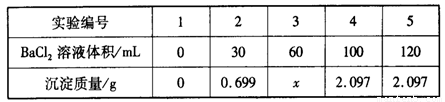
下列有关说法不正确的是
A.混合前,BaCl2溶液的物质的量浓度为0.10 mol·L-1
B.混合前,Na2SO4溶液的物质的量浓度为0.15 mol·L-1
C.3号实验中沉淀的质量x为1.398 g
D.完全沉淀60 mL Na2SO4溶液消耗BaCl2溶液的体积为80 mL
D
【解析】
试题分析:根据加入100mL氯化钡溶液生成2.097g沉淀,沉淀质量大于加入30mL氯化钡溶液时所产生沉淀质量,据此可判断加入30mL氯化钡溶液时,混合溶液中的硫酸钠未完全反应,则向混合溶液中加入氯化钡溶液完全反应可生成硫酸钡沉淀质量比=30mL:0.699g;按此关系,若分别加入60mL氯化钡溶液完全反应,应得到硫酸钡沉淀为x= 60mL/30mL×0.699g=1.398g,完全沉淀60 mL Na2SO4溶液应生成2.097g恰好生成2.097g沉淀需氯化钡溶液的体积为2.097g/0.699g×30mL=90mL。故D错误。
考点:考查物质的量的有关计算等相关知识。


科目:高中化学 来源: 题型:
 向20mL5mol/L的 AlCl3溶液中滴入2.5mol/L NaOH溶液时,得到沉淀的质量与所滴加NaOH溶液的体积有如图关系:
向20mL5mol/L的 AlCl3溶液中滴入2.5mol/L NaOH溶液时,得到沉淀的质量与所滴加NaOH溶液的体积有如图关系:查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
A.4.32 g B.4.68 g C.5.36 g D.6.38 g
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com