
【题目】常温下,下列有关稀溶液中离子浓度的说法正确的是( )
A.同浓度的四种溶液:①NH4Cl ②(NH4)2SO4③NH4HSO4④NH4Al(SO4)2溶液,c(NH4+)浓度的大小关系:②>④>③>①
B.一定浓度的NaHS溶液中:c(Na+)+c(OH﹣)=c(H+)+c(HS﹣)+2c(H2S)
C.若0.1 mol/L NH4Cl溶液pH=5,则其中离子浓度最大与最小的差值为(0.1﹣10﹣5)mol/L
D.现有四种溶液:①pH=4的H2SO4溶液 ②pH=4的NH4Cl溶液 ③pH=10的氨水 ④pH=10的CH3COONa溶液,其中水电离出的氢离子浓度大小关系为:②=④>③>①
【答案】B
【解析】解:A.①NH4Cl ②(NH4)2SO4 ③NH4HSO4 ④NH4Al(SO4)2中,先不考虑水解,则②(NH4)2SO4中含有两个NH4+,所以它们NH4+的浓度大于其它三种物质,溶液中c(NH4+)根据盐类水解的影响分析判断,③NH4HSO4 ,④NH4Al(SO4)2中,③NH4HSO4 溶液中氢离子抑制铵根离子的水解,④NH4Al(SO4)2中铝离子水解抑制铵根离子的水解,c(NH4+)浓度的大小关系:②>③>④>①,故A错误;
B.一定浓度的NaHS溶液中存在质子守恒为:c(Na+)+c(OH﹣)=c(H+)+c(HS﹣)+2c(H2S),故B正确;
C.若0.1 mol/L NH4Cl溶液pH=5,溶液中最大的离子浓度为Cl﹣离子,浓度为0.1mol/L,铵根离子水解溶液显酸性,溶液中氢氧根离子浓度最小,c(OH﹣)= ![]() =
= ![]() =10﹣9mol/L,则其中离子浓度最大与最小的差值为(0.1﹣10﹣9)mol/L,故C错误;
=10﹣9mol/L,则其中离子浓度最大与最小的差值为(0.1﹣10﹣9)mol/L,故C错误;
D.现有四种溶液:①pH=4的H2SO4溶液 ③pH=10的氨水,④pH=10的CH3COONa溶液,②pH=4的NH4Cl溶液,①③抑制水的电离,②④促进水的电离,
其中水电离出的氢离子浓度大小关系为①=③<②=④,故D错误;
故选B.
A.①NH4Cl ②(NH4)2SO4 ③NH4HSO4 ④NH4Al(SO4)2中,先不考虑水解,则②(NH4)2SO4中含有两个NH4+,所以它们NH4+的浓度大于其它三种物质,溶液中c(NH4+)根据盐类水解的影响分析判断,③NH4HSO4 ,④NH4Al(SO4)2中,③NH4HSO4 溶液中氢离子抑制铵根离子的水解,④NH4Al(SO4)2中铝离子水解抑制铵根离子的水解,c(NH4+)根据盐类水解的影响分析判断;
B.NaHS溶液中存在质子守恒分析;
C.若0.1 mol/L NH4Cl溶液pH=5,溶液中最大的离子浓度为Cl﹣离子,浓度为0.1mol/L,铵根离子水解溶液显酸性,溶液中氢氧根离子浓度最小,c(OH﹣)= ![]() ;
;
D.酸碱抑制水的电离,水解的盐促进水的电离;


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】下列化学方程式或离子方程式正确的是( )
A.用铜做电极电解CuSO4溶液:2Cu2++2H2O=2Cu↓+O2↑+4H+
B.惰性电极电解MgCl2溶液:2Cl﹣+2H2O ![]() 2OH﹣+Cl2↑+H2↑
2OH﹣+Cl2↑+H2↑
C.乙醛溶液中加入新制碱性Cu(OH)2悬浊液并加热CH3CHO+2 Cu(OH)2+OH﹣ ![]() CH3COO﹣+Cu2O↓+3H2O
CH3COO﹣+Cu2O↓+3H2O
D.硝酸银溶液中滴加过量氨水:Ag++NH3H2O═AgOH↓+NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香酯I的合成路线如下:
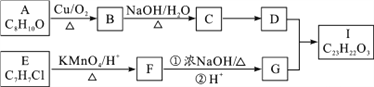
已知以下信息:
①A~I均为芳香族化合物,B能发生银镜反应,D的相对分子质量比C大4,E的苯环上的一溴代物有两种。
②![]()
③
请回答下列问题:
(1)A→B的反应类型为________,D所含官能团的名称为________,E的名称为________。
(2)E→F与F→G的顺序能否颠倒________(填“能”或“否”),理由________。
(3)B与银氨溶液反应的化学方程式为______________________________________________________。
(4)I的结构简式为_____________________________。
(5)符合下列要求A的同分异构体还有________种。
①与Na反应并产生H2 ②芳香族化合物
(6)根据已有知识并结合相关信息,写出以CH3CH2OH为原料制备CH3CH2CH2CH2OH的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:_____________________
CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物H是合成免疫抑制剂药物霉酚酸的中间体,可由如下路径合成得到. 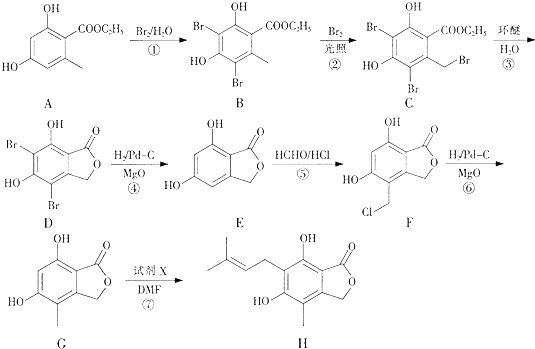
(1)有机物A中的含氧官能团的名称为 .
(2)由C转化为D的反应类型为 .
(3)反应⑦除了得到有机物H外还得到HBr,试剂X的结构简式为 .
(4)步骤⑤可得到副产品有机物J,有机物J和有机物F互为同分异构体,写出有机物J的结构简式:(任写一种).
(5)E的一种同分异构体满足下列条件: Ⅰ.可以发生银镜反应,且能够与NaHCO3反应产生CO2;
Ⅱ.是芳香族化合物,且核磁共振氢谱图显示分子中有4种不同化学环境的氢.
写出该同分异构体的结构简式: .
(6)已知:直接与苯环相连的卤素原子难以与NaOH水溶液发生取代反应.根据已有知识并结合相关信息,写出以 ![]() HCHO为原料制备
HCHO为原料制备 ![]() 合成路线流程图(无机试剂任用).合成路线流程图示例如下: CH3CH2OH
合成路线流程图(无机试剂任用).合成路线流程图示例如下: CH3CH2OH ![]() H2C=C2H
H2C=C2H ![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修 3:物质结构与性质]
(1) 过渡金属元素铁能形成多种配合物,如:[Fe (CN) 6] 4-、[Fe(SCN)6]3-等。
Fe3+的核外电子排布式为______________,从原子结构的角度解释Fe3+比Fe2+稳定的理由是_______________。
(2) N的基态原子中能量最高的电子,其电子云在空间有________个方向,原子轨道呈________形。
(3) (NH4)2SO4阴离子的立体构型是________,NH4+中心原子的杂化类型是________。
(4) Fe有δ、γ、α三种同素异形体,其晶胞结构如下图所示:

① δ、α两种晶体晶胞中铁原子的配位数之比为_____________。
②1个γ晶体晶胞中所含有的铁原子数为_____________。
③若Fe原子半径为rpm,NA表示阿伏加德罗常数的值,则δ-Fe单质的密度为____________g/cm3(列出算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com