
氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:

(1)MgCO3与稀硫酸反应的离子方程式为_______________________________。
(2)加入H2O2氧化时,发生反应的化学方程式为______________________________。
(3)滤渣2的成分是________(填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。

①D中收集的气体是________(填化学式)。
②B中盛放的溶液可以是________(填字母)。
a.NaOH溶液 b.Na2CO3溶液 c.稀硝酸 d.KMnO4溶液
③A中得到的淡黄色固体能与热的NaOH溶液反应,产物中元素的最高价态为+4,写出该反应的离子方程式:____________________。
(1)MgCO3+2H+=Mg2++CO2↑+H2O
(2)2FeSO4+H2O2+H2SO4=Fe2(SO4)3+2H2O
(3)Fe(OH)3
(4)①CO ②d ③3S+6OH-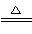 2S2-+SO32—+3H2O
2S2-+SO32—+3H2O
【解析】 (1)MgCO3微溶于水写离子方程式时不能拆成离子形式,硫酸是强酸能拆成离子形式。(2)由于菱镁矿中含有FeCO3,所以溶液中存在FeSO4,要除去杂质Fe2+可先将其氧化成Fe3+,再调节pH除去,因此H2O2是氧化剂,发生反应:2FeSO4+H2O2+H2SO4=Fe2(SO4)3+2H2O。(3)用氨水调节pH=4除去Fe3+,滤渣2为Fe(OH)3。(4)题目中要求利用图中装置进行气体的分步吸收或收集。煅烧后存在四种气体:S、SO2、CO2和CO。由③可知A中得淡黄色固体,即S,B吸收SO2,C吸收CO2,D中收集CO。B吸收SO2但不吸收CO2,可选用KMnO4溶液,注意不能用NaOH溶液或Na2CO3溶液,因为它们吸收SO2的同时也吸收CO2,题目要求是分步吸收。③中发生S与热的NaOH溶液反应,产生+4价硫的化合物即Na2SO3,说明另外有硫元素的化合价降低,即有-2价硫的化合物生成,其离子方程式为:3S+6OH- 2S2-+SO32—+3H2O。
2S2-+SO32—+3H2O。


科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第3讲两种重要的化学反应练习卷(解析版) 题型:选择题
在水溶液中能大量共存的一组离子是( )。
A.Na+、Ba2+、Cl-、NO3— B.Pb2+、Hg2+、S2-、SO42—
C.NH4+、H+、S2O32—、PO43— D.Ca2+、Al3+、Br-、CO32—
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第13讲实验方案设计与评价练习卷(解析版) 题型:实验题
TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。
(1)实验室利用反应TiO2(s)+CCl4(g) TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下:
TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下:

有关物质性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | -23 | 76 | 与TiCl4互溶 |
TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
仪器A的名称是________。装置E中的试剂是________。反应开始前依次进行如下操作:组装仪器、________、加装药品、通N2一段时间后点燃酒精灯。反应结束后的操作包括:①停止通N2 ②熄灭酒精灯 ③冷却至室温。正确的顺序为________(填序号)。欲分离D中的液态混合物,所采用操作的名称是________。
(2)工业上由钛铁矿(FeTiO3)(含Fe2O3、SiO2等杂质)制备TiO2的有关反应包括:
酸溶 FeTiO3(s)+2H2SO4(aq)=FeSO4(aq)+TiOSO4(aq)+2H2O(l)
水解 TiOSO4(aq)+2H2O(l) H2TiO3(s)+H2SO4(aq)
H2TiO3(s)+H2SO4(aq)
简要工艺流程如下:

①试剂A为________。钛液Ⅰ需冷却至70 ℃左右,若温度过高会导致产品TiO2产率降低,原因是_________________________________________________
_______________________。
②取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是________。这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2也会发黄,发黄的杂质是____________________(填化学式)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第11讲有机化学基础练习卷(解析版) 题型:填空题
莫沙朵林是一种镇痛药,它的合成路线如下:

(1)B中手性碳原子数为________;化合物D中含氧官能团的名称为________。
(2)C与新制氢氧化铜反应的化学方程式为_______________________。
(3)写出同时满足下列条件的E的一种同分异构体的结构简式:_________________________________________________。
①核磁共振氢谱有4个峰;
②能发生银镜反应和水解反应;
③能与FeCl3溶液发生显色反应。
(4)已知E+X―→F为加成反应,化合物X的结构简式为____________。
(5)已知: 化合物
化合物 是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以
是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以 和
和 为原料合成该化合物(用合成路线流程图表示,并注明反应条件)。合成路线流程图示例如下:
为原料合成该化合物(用合成路线流程图表示,并注明反应条件)。合成路线流程图示例如下:
CH3CH2OH CH2===CH2
CH2===CH2

查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第11讲有机化学基础练习卷(解析版) 题型:选择题
阿司匹林是日常生活中应用广泛的医药之一。它可由下列方法合成:

下列说法正确的是( )。
A.邻羟基苯甲醛分子中所有的原子不可能在同一平面
B.用酸性KMnO4溶液直接氧化邻羟基苯甲醛可实现反应①
C.反应②中加入适量的NaHCO3可提高阿司匹林的产率
D.与邻羟基苯甲酸互为同分异构体,苯环上一氯代物仅有2种且能发生银镜反应的酚类化合物共有4种
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第10讲金属元素及其化合物练习卷(解析版) 题型:选择题
下列转化关系在给定条件下不能实现的是( )。

A.①②③ B.②③⑤ C.③④⑤ D.①②③④
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习提分训练专题12物质结构与性质(选修)练习卷(解析版) 题型:填空题
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:
(1)C、Si、N元素的电负性由大到小的顺序是___________________,
C60和金刚石都是碳的同素异形体,二者相比,熔点高的是________,原因是____________________________。
(2)A、B均为短周期金属元素,依据表中数据,写出B的基态原子的电子排布式:________________。
电离能/(kJ·mol-1) | I1 | I2 | I3 | I4 |
A | 932 | 1 821 | 15 390 | 21 771 |
B | 738 | 1 451 | 7 733 | 10 540 |
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,d0或d10排布无颜色,d1~d9排布有颜色。如[Co(H2O)6]2+显粉红色。据此判断:[Mn(H2O)6]2+________(填“无”或“有”)颜色。
(4)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。
①COCl2分子的结构式为 ,每个COCl2分子内含有________个σ键,________个π键,其中心原子采取________杂化轨道方式。
,每个COCl2分子内含有________个σ键,________个π键,其中心原子采取________杂化轨道方式。
②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g)。反应过程中,断裂的化学键只有配位键,则形成的化学键类型是________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习提分训练 专题9非金属元素及其化合物练习卷(解析版) 题型:填空题
氯气是重要的化工原料。
(1)氯气溶于水得到氯水,氯水中存在下列反应:Cl2+H2O??H++Cl-+HClO,其平衡常数表达式为K=________。
(2)工业上常用熟石灰和氯气反应制取漂白粉,反应的化学方程式是____________________________。流程如下图所示,其主要设备是氯化塔,塔从上到下分四层。将含有3%~6%水分的熟石灰从塔顶喷洒而入,氯气从塔的最底层通入,这样加料的目的是__________________________。处理从氯化塔中逸出气体的方法是________。

(3)某科研小组在实验室用较浓的KOH溶液直接吸收氯气,研究发现反应进行一段时间后开始出现KClO3并逐渐增多,产生KClO3的离子方程式是____________________________________,其原因可能是__________________,由此可知(2)中氯化塔设计为四层是为了减少生产中类似副反应的发生。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习提分训练 专题4物质结构元素周期律练习卷(解析版) 题型:选择题
有A、B、C、D、E五种短周期元素,A是地壳中含量最多的元素,B元素有3种同位素B1、B2、B3,B3原子的质量数是B1的3倍,C是非金属性最强的元素,D和C可以形成DC型离子化合物,且离子的电子层结构相同,E元素原子的最外层电子数比内层电子总数少6个。下列说法正确的是( )。
A.离子半径:D+>C-
B.EA2是光导纤维的主要成分
C.A和B可以形成原子个数比1∶1的化合物
D.以上元素中形成的最高价氧化物对应的水化物的酸性最强的是C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com