
 (1)写出Fe2+的最高能层的电子排布式:3s23p63d6.将Fe2O3、KNO3、KOH混合加热共融可制取绿色净水剂K2FeO4,其中KNO3被还原为KNO2,写出该反应的化学方程式Fe2O3+3KNO3+4KOH$\frac{\underline{\;高温\;}}{\;}$2K2FeO4+3KNO2+2H2O.
(1)写出Fe2+的最高能层的电子排布式:3s23p63d6.将Fe2O3、KNO3、KOH混合加热共融可制取绿色净水剂K2FeO4,其中KNO3被还原为KNO2,写出该反应的化学方程式Fe2O3+3KNO3+4KOH$\frac{\underline{\;高温\;}}{\;}$2K2FeO4+3KNO2+2H2O.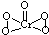 .
.分析 (1)铁是26号元素,铁原子核外有26个电子,铁原子失去2个电子变为Fe2+,根据构造原理写出Fe2+基态离子核外电子排布式与最高能层的电子排布式;将Fe2O3、KNO3、KOH混合加热共融可制取绿色净水剂K2FeO4,其中KNO3被还原为KNO2,同时还生成KNO2和H2O,依据化学方程式的书写原则,原子守恒,氧化还原反应的化合价升降总数相同进行配平;
(2)根据配合物组成判断配位数,CrO5中存在过氧键、Cr-O键、Cr=O,在4个Cr-O键中Cr为+1价,在Cr=O键注重Cr为+2价,以此书写结构式;
(3)Ni的价电子数为10,每个配体提供一个电子对,根据10+2n=18计算;
(4)①碳化硅是空间网状结构,为原子晶体,每个硅原子连接4个碳原子,形成正四面体结构;
②距离中心Si最近的第一层的4个C原子,每一个又连接着另外3个Si原子,这12个Si原子平均分布在一个球面上,根据直角三角形计算正四面体的边长;
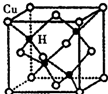
(5)利用均摊法计算该晶胞中含有的铜原子和氢原子个数,再根据质量、密度和体积之间的关系式ρ=$\frac{m}{V}$计算.
解答 解:(1)铁是26号元素,铁原子核外有26个电子,铁原子失去2个电子变为Fe2+,根据构造原理知,该离子核外电子排布式为1s22s22p63s23p63d6,最高能层的电子排布式:3s23p63d6;
将Fe2O3、KNO3、KOH混合加热共融可制取绿色净水剂K2FeO4,其中KNO3被还原为KNO2,同时还生成KNO2和H2O,配平得到化学方程式为:Fe2O3+3KNO3+4KOH$\frac{\underline{\;高温\;}}{\;}$2K2FeO4+3KNO2+2H2O;
故答案为:3s23p63d6;Fe2O3+3KNO3+4KOH$\frac{\underline{\;高温\;}}{\;}$2K2FeO4+3KNO2+2H2O;
(2)[Cr(H2O)4Cl2]Cl•2H2O中Cr与4个H2O,2个Cl-形成配位键,所以配位数为6,CrO5中存在过氧键、Cr-O键、Cr=O,在4个Cr-O键中Cr为+1价,在Cr=O键中Cr为+2价,则结构式为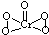 ;
;
故答案为:6;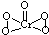 ;
;
(3)Ni的价电子数为10,每个配体提供一个电子对,则10+2n=18,故n=4,
故答案为:4;
(4)①碳化硅是空间网状结构,为原子晶体,每个硅原子连接4个碳原子,形成正四面体结构,其键角为109°28′;
故答案为:原子;109°28′;
②距离中心Si最近的第一层的4个C原子,每一个又连接着另外3个Si原子,则与硅原子次近的第二层有12个Si原子,这12个Si原子平均分布在一个球面上,F是C原子,A、B、C、D分别代表一个Si原子,AB、AC、AD、BC、BD、CD的边长相等,AF、BF的长相等为d,F位于体心上,O位于正三角形BCD的重心上,在正三角形BCD中,BE为三角形BCD的高,则CE为BC的一半,如图 ,设正四面体的边长为x,CE的长为0.5x,BE=$\sqrt{{x}^{2}-(0.5x){\;}^{2}}$,BO与OE的长之比为2:1,则BO的长为$\frac{\sqrt{3}}{2}$x×$\frac{2}{3}$=$\frac{\sqrt{3}}{3}$x,在三角形ABO中,AO的长=${\sqrt{{x}^{2}-(\frac{\sqrt{3}}{3}x)}}^{2}$=$\frac{\sqrt{6}}{3}x$,在三角形BFO中,OF的长=$\frac{\sqrt{6}}{3}$x-d=$\sqrt{{d}^{2}-(\frac{\sqrt{3}}{3}x})^{2}$,x=$\frac{2\sqrt{6}}{3}d$,
,设正四面体的边长为x,CE的长为0.5x,BE=$\sqrt{{x}^{2}-(0.5x){\;}^{2}}$,BO与OE的长之比为2:1,则BO的长为$\frac{\sqrt{3}}{2}$x×$\frac{2}{3}$=$\frac{\sqrt{3}}{3}$x,在三角形ABO中,AO的长=${\sqrt{{x}^{2}-(\frac{\sqrt{3}}{3}x)}}^{2}$=$\frac{\sqrt{6}}{3}x$,在三角形BFO中,OF的长=$\frac{\sqrt{6}}{3}$x-d=$\sqrt{{d}^{2}-(\frac{\sqrt{3}}{3}x})^{2}$,x=$\frac{2\sqrt{6}}{3}d$,
故答案为:12;$\frac{2\sqrt{6}}{3}d$;
(5)该晶胞中含有4个H原子,铜原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,所以该晶胞中含有4个铜原子4个氢原子,设该晶胞的边长为a,则d=$\frac{\frac{4×(64+1)}{{N}_{A}}}{{a}^{3}}$,所以a=$\root{3}{\frac{260}{dN{\;}_{A}}}$,
故答案为:$\root{3}{\frac{260}{dN{\;}_{A}}}$.
点评 本题考查较为综合,题目难度较大,涉及晶胞的计算、价电子排布式的书写、等电子体、化学键等知识点,晶胞的计算是学习难点,应熟练掌握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 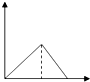 | B. | 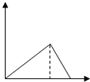 | C. | 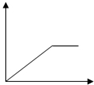 | D. | 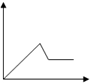 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠的密度比水大 | |
| B. | 碳酸钠可用于治疗胃酸过多 | |
| C. | 钠着火可用湿布盖灭 | |
| D. | 过氧化钠露置于空气中会变成碳酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 s | B. | 2 s | C. | 44 s | D. | 1.33 s |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com