
【题目】CH4分子的形状是
A.正五边形B.正方形C.正四面体D.四棱柱
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】电讯器材元件材料MnCO3在空气中加热易转化为不同价态锰的氧化物,其固体残留率随温度变化如下图。下列说法不正确的是( )
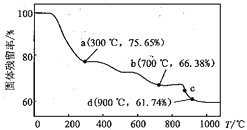
A. a 点剩余固体中n(Mn) : n(O) = 1 : 2
B. b 点对应固体的成分为Mn3O4
C. c 点发生的反应为2MnO2 △ 2MnO+O2↑
D. d 点对应固体的成分为MnO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究Na 与CO2反应产物,某化学兴趣小组按下图装置进行实验。
已知:CO + 2Ag ( NH3) 2OH=2Ag↓+( NH4 ) 2CO3 +2NH3

回答下列问题:
(1)写出A 中反应的离子方程式__________________________。
(2)仪器X 的名称是_____________,B 中的溶液为________________。
(3)先称量硬质玻璃管的质量为m1 g ,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是m2 g 。再进行下列实验操作,其正确顺序是________(填标号);
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,通入CO2至E 中出现浑浊
e.称量硬质玻璃管 f.冷却到室温
重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3 g 。
(4)加热硬质玻璃管一段时间,观察到以下现象
① 钠块表面变黑,熔融成金属小球;
② 继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,管中有大量黑色物质;③ F 中试管内壁有银白物质产生。
产生上述②现象的原因是____________________________________。
(5)探究固体产物中元素Na 的存在形式
假设一:只有Na2CO3;假设二:只有Na2O ;假设三:Na2O和Na2CO3均有
完成下列实验设计,验证上述假设:
步骤 | 操作 | 结论 |
1 | 将硬质玻璃管中的固体产物溶于水后过滤 | 假设一成立 |
2 | 往步骤1所得滤液中___________________________ | |
3 | _____________________________________________ |
(6)根据上述实验现象及下表实验数据,写出Na 与CO2反应的总化学方程式___________。
m1 | m2 | m3 |
66.7g | 69.0g | 72.1g |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化钠是重要的化工原料,大多采用无水芒硝(Na2SO4)—炭粉还原法制备,原理为:Na2SO4+2CNa2S+2CO2↑。其主要流程如下:

(1) 上述流程中采用稀碱液比用热水更好,理由是________________________________________________________________________。
(2) 已知:I2+2S2O32-===2I-+S4O62-。所制得的Na2S·9H2O晶体中含有Na2S2O3·5H2O等杂质。为测定产品的成分,进行下列实验,步骤如下:
a. 取试样10.00 g配成500.00 mL溶液。
b. 取所配溶液25.00 mL于碘量瓶中,加入过量ZnCO3悬浊液除去Na2S后,过滤,向滤液中滴入2~3滴淀粉溶液,用0.050 00 mol·L-1 I2溶液滴定至终点,用去5.00 mL I2溶液。
c. 再取所配溶液25.00 mL于碘量瓶中,加入50.00 mL 0.050 00 mol·L-1的I2溶液,并滴入2~3滴淀粉溶液,振荡。用标准Na2S2O3溶液滴定多余的I2,用去15.00 mL 0.100 0 mol·L-1 Na2S2O3溶液。
①步骤b中用ZnCO3除去Na2S的离子方程式为____________。
②判断步骤c中滴定终点的方法为______________。
③计算试样中Na2S·9H2O和Na2S2O3·5H2O的质量分数,写出计算过程__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KO2的晶体结构与NaCl相似,KO2可以看作是Na+的位置用K+代替,Cl-的位置用O22-代替(如图),晶体中含有的哑铃形O22-使晶胞沿一个方向拉长。下列对于KO2晶体结构的描述正确的是( )

A. 与K+距离最近且相等的O2-共有4个 B. KO2的熔点比RbO2的熔点低
C. 与K+距离最近且相等的K+有12个 D. 一个KO2晶胞的质量为284 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、l0lkPa下,煤炭、氢气、天然气和甲醇(CH3OH)四种燃料的热值(指一定条件下,单位质量的物质完全燃烧所放出的热量)依次是33kJ·g-1、143 kJ·g-1、56 kJ·g-1、23 kJ·g-1。则下列热化学方程式正确的是
A. C(s)+l/2O2(g)=CO(g) △H= -396kJ·mol-1
B. 2H2(g)+O2(g)=2H2O(l) △H= -286 kJ·mol-1
C. CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H= -896 kJ·mol-1
D. CH3OH(l)+O2(g)=CO2(g)+2H2O(l) △H= -736 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A. 12g石墨中含有C-C键的个数为1.5NA B. 60g SiO2中含有Si-O键的个数为2NA
C. 124 g P4中含P-P键的个数为4 NA D. 12 g金刚石中含C-C键的个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂对工业污泥中的Cr元素回收与再利用的工艺如下(已知硫酸浸取液中的金属离子主要是Cr3+,其次是少量的Fe2+、Fe3+、Al3+、Ca2+、Mg2+):
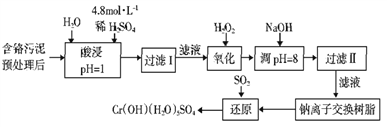
部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | —— | —— | —— |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 9(>9溶解) |
(1)实验室用98%(密度为1.84g·cm-3)的浓硫酸配制200 mL 4.8 mol·L-1的硫酸溶液,配制时需要量取98%的浓硫酸的体积为_______ mL(保留小数点后一位小数),所用的玻璃仪器除烧杯、玻璃棒、量筒和酸式滴定管外,还需_______。
(2)过滤操作时,需要对沉淀进行洗涤,洗涤沉淀的方法是_______。
(3)加入H2O2的作用一方面是氧化+3价Cr使之转变成+6价Cr(CrO42-或Cr2O72-),以便于与杂质离子分离:另一方面是_______。(离子方程式表示)
(4)调节溶液的pH=8除去的杂质离子是_______。
(5)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的杂质离子是_______。
(6)通SO2气体时,还原过程发生以下反应(填写缺项物质并配平):
____ Na2Cr2O7+ SO2+ = Cr(OH)(H2O)5SO4+ Na2SO4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列广告语在科学性上正确的是( )
A. 本产品XX牌八宝粥由莲子、淀粉、桂圆等精制而成,适合糖尿病患者,绝对不含糖
B. 请放心饮用农夫山泉系列饮品,该饮品绝对不含任何化学物质
C. 服用鱼肝油(富含维生素D)有助于您的宝宝骨骼健康,有利于骨骼发育
D. 这种口服液含有丰富的N、P、Zn等微量元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com