
【题目】下图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B. C. D. E是非金属单质,且在常温常压下都是气体,化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应。
请回答下列问题:

(1)用元素符号表示各物质:A___、B____. C______. D______. E______.F_____. G____、I___。
(2)写出下列物质间反应的化学方程式:A和B_____________,F和CO2______________,D和E________________________,I和J ___________________.
(3)写出化合物G与I反应的离子方程式_______________________________。
【答案】Na O2 Cl2 H2 N2 Na2O2 Na2CO3 HCl 2Na+O2 ![]() Na2O2 2Na2O2+2CO2=2Na2CO3+O2 N2+3H2
Na2O2 2Na2O2+2CO2=2Na2CO3+O2 N2+3H2![]() 2NH3 HCl+NH3=NH4Cl CO32-+2H+=CO2↑+H2O
2NH3 HCl+NH3=NH4Cl CO32-+2H+=CO2↑+H2O
【解析】
化合物G的焰色反应为黄色,即G中含有Na元素,反应①是化工生产中的一种重要固氮反应,即该反应为N2+3H2![]() 2NH3,即J为NH3,I与NH3形成铵盐,即I为酸,C和D在光照条件下发生反应,C、D、E是非金属单质,且在常温常压下都是气体,即C为Cl2,D为H2,E为N2,I为HCl,F与CO2反应生成气体单质B和钠的化合物,推出F为Na2O2,B为O2,G为Na2CO3,A为Na。
2NH3,即J为NH3,I与NH3形成铵盐,即I为酸,C和D在光照条件下发生反应,C、D、E是非金属单质,且在常温常压下都是气体,即C为Cl2,D为H2,E为N2,I为HCl,F与CO2反应生成气体单质B和钠的化合物,推出F为Na2O2,B为O2,G为Na2CO3,A为Na。
化合物G的焰色反应为黄色,即G中含有Na元素,反应①是化工生产中的一种重要固氮反应,即该反应为N2+3H2![]() 2NH3,即J为NH3,I与NH3形成铵盐,即I为酸,C和D在光照条件下发生反应,C、D、E是非金属单质,且在常温常压下都是气体,即C为Cl2,D为H2,E为N2,I为HCl,F与CO2反应生成气体单质B和钠的化合物,推出F为Na2O2,B为O2,G为Na2CO3,A为Na。
2NH3,即J为NH3,I与NH3形成铵盐,即I为酸,C和D在光照条件下发生反应,C、D、E是非金属单质,且在常温常压下都是气体,即C为Cl2,D为H2,E为N2,I为HCl,F与CO2反应生成气体单质B和钠的化合物,推出F为Na2O2,B为O2,G为Na2CO3,A为Na。
(1)根据上述分析,A为Na,B为O2,C为Cl2,D为H2,E为N2,F为Na2O2,G为Na2CO3,I为HCl;
(2)A和B的反应为2Na+O2 ![]() Na2O2;F和CO2的反应:2Na2O2+2CO2=2Na2CO3+O2;D和E的反应为N2+3H2
Na2O2;F和CO2的反应:2Na2O2+2CO2=2Na2CO3+O2;D和E的反应为N2+3H2![]() 2NH3;I和J的反应NH3+HCl=NH4Cl;
2NH3;I和J的反应NH3+HCl=NH4Cl;
(3)G和I反应的离子方程式为CO32-+2H+=CO2↑+H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是

A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )


A. 图Ⅰ所示装置用于 Cu 和浓 H2SO4 制取少量的 SO2 气体
B. 图Ⅱ装置可验证非金属性:Cl>C>Si
C. 图Ⅲ可用于收集气体 H2、CO2、Cl2、NH3
D. 图Ⅳ表示将 SO2 气体通入 H2S 水溶液中,所得溶液的 pH 变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298 K时,各反应的平衡常数如下:
①N2(g)+O2(g)![]() 2NO(g),K=1×10-30;
2NO(g),K=1×10-30;
②2H2(g)+O2(g)![]() 2H2O(g),K=2×1081;
2H2O(g),K=2×1081;
③2CO2(g)![]() 2CO(g)+O2(g),K=4×10-92
2CO(g)+O2(g),K=4×10-92
则常温下,NO、H2O、CO2这三个化合物分解放氧的倾向最大的是( )
A.① B.② C.③ D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时, 在一个2 L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:

(1)该反应的化学方程式为 _____________________________。
(2)反应开始至2 min,以气体Z表示的平均反应速为 ___________________________。
(3)若X、Y、Z均为气体,2 min后反应达到平衡,反应达平衡时:
①此时体系的压强是开始时的_____________倍;
②达平衡时,容器内混合气体的平均相对分子质量比起始投料时 ___(填”增大”“减小”或”相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置不能完成相应实验的是
A. 测定乙醇的结构式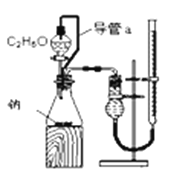
B. 验证火柴燃烧生成的SO2气体
C. 验证溴乙烷在该条件下会生成不饱和烃
D. 研究催化剂对反应速率的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:

(1)电极X的材料是______;电解质溶液Y是________;
(2)银电极为电池的____极,发生的电极反应式为______; X电极上发生的电极反应为______;(填反应类型)
(3)外电路中的电子是从_______电极流向________电极。Ag+向_______ (填正极或负极)移动。
(4)当有1.6g铜溶解时,银棒增重_________________。
(5)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为:A极:H2+O2--2e-=H2O; B极:O2+4e-=2O2-。则A极是电池的______极;电子从该极____(填“流入”或“流出”),该电池的总反应为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中发生反应:2A(g)+2B(g)![]() C(s)+3D(g) ΔH<0,达到平衡时采取下列措施,可以使正反应速率v正增大、D的物质的量浓度c(D)增大的是( )
C(s)+3D(g) ΔH<0,达到平衡时采取下列措施,可以使正反应速率v正增大、D的物质的量浓度c(D)增大的是( )
A. 移走少量C B. 扩大容积,减小压强
C. 缩小容积,增大压强 D. 容积不变,充入“惰”气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气与生态圈的氮循环如图所示,下列叙述不正确的是

A. ④维持大气中氮元素含量稳定
B. ①是野生植物生长所需氮元素的重要来源
C. ⑤为硝化过程、④为反硝化过程,都是氮元素的还原反应过程
D. ②是氮肥工业基础,科学家努力将固氮变化条件趋近生物固氮
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com