
| A�������ʵ���Ũ��NaCl��CH3COONa��Һ�������ϣ� c(Cl-)>c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| B��25��ʱ����10mL���ᣨpHa����100mLBa��OH��2��Һ��pHn����Ϻ�ǡ���кͣ���pHa+pHn=13 |
| C�������ʵ���Ũ�ȵ��������������Һ�������ϣ�c��SO42-��+c��OH-��=c��H+��+c��CH3COOH�� |
D����ˮ�м�ˮϡ�ͣ� ��С ��С |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A��c(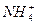 )=c(Na+)=c(OH-)��c(NH3��H2O) )=c(Na+)=c(OH-)��c(NH3��H2O) |
B��c(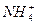 )=c(Na+)��c(NH3��H2O)��c(OH-) )=c(Na+)��c(NH3��H2O)��c(OH-) |
C��c(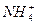 )��c(Na+)��c(OH-)��c(NH3��H2O) )��c(Na+)��c(OH-)��c(NH3��H2O) |
D��c(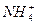 )��c(Na+)��c(NH3��H2O)��c(OH-) )��c(Na+)��c(NH3��H2O)��c(OH-) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��������ˮ |
| B��ʹ���ȵĴ�����Һȥ������ |
| C��ʵ��������FeCl3��Һʱ��������ϡ���� |
| D��ʵ����������ʱ����CuSO4�ɼӿ췴Ӧ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��c(Na+)+c(H+)=c(OH+)+c(HCO3-)+c(CO32-) |
| B��2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)] |
| C��c(Na+)>c(HCO3-)>c(CO32-)>c(OH+)>c(H+) |
| D��2c(OH+)+c(CO32-)=c(HCO3-)+3c(H2CO3)+2c(H+) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��pH = 2�Ĵ�����Һ��pH = 12��NaOH��Һ�������ϣ� c (Na��)��c(CH3COO��)��c(H��)��c(OH��) |
| B�������ʵ���Ũ�ȵ�H2S��NaHS�����Һ�У� c(Na��)�� c(H��) = c(S2��)�� c(HS��)�� c(OH��) |
| C��NaHCO3��Һ�У�c(OH��)��c(H��)��c(H2CO3)��c(CO32��) |
| D��0.1 mol��L��1Na2CO3��Һ��0.1 mol��L��1NaHCO3��Һ�������ϣ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ͬ���ʵ���Ũ�ȵ�������Һ�У���NH4Al(SO4)2��NH4Cl��CH3COONH4��NH3��H2O��c(NH4+) �ɴ�С��˳���ǣ��٣��ڣ��ۣ��� |
B�����ʵ���Ũ����ȵ� H2S �� NaHS �����Һ�У�c(Na +) + c(H+) = c(S2�D) + c(HS�D) + c(OH�D) +) + c(H+) = c(S2�D) + c(HS�D) + c(OH�D) |
| C��ͬ��ʱ��HF��HCN���룬��NaF��Һ��pH ��NaCN ��Һ��pHС |
| D�������£�BaSO4(s)�ڴ�ˮ�е��ܽ������ϡ������Һ���ܽ����ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����pH=7ʱ��c��Na����=c��CH3COO����>c��H����=c��OH���� |
| B����pH>7ʱ��c��CH3COO����>c��Na����>c��OH����>c��H+�� |
| C����ǡ����ȫ�к�ʱ��c��Na����>c��CH3COO����>c��OH����>c��H���� |
| D����Ӧȫ�̶��й�ϵ��c��Na����+c��H����=c��CH3COO����+c��OH���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��1 | B��0.1 | C��10 | D��0.01 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
|
|
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com