
每年世界上钢铁的产量很高,但钢铁腐蚀也给人类带来了巨大的损失,因此如何更好地进行金属防护,一直是科学研究领域中的重要课题。
(1)钢铁在潮湿的空气中的锈蚀主要属于________,沿海地区的钢铁腐蚀比内
陆地区更严重的原因是_____________________________________________
_________________________________________________________________。
(2)据环保部门测定,我国一些大城市的酸雨pH=3.5。在酸雨季节铁制品极
易腐蚀,则在其腐蚀中正极发生的反应是_____________________________。
(3)在工业上常用亚硫酸钠除去水中溶解的氧,防止输水管被腐蚀,请简要说
明原因____________________________________________________________
_________________________________________________________________。
 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案科目:高中化学 来源: 题型:
实验室可用NaBr、浓H2SO4、乙醇为原料制备少量溴乙烷:
C2H5—OH+HBr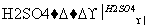 C2H5Br+H2O
C2H5Br+H2O
已知反应物的用量为0.30 mol NaBr(s);0.25 mol C2H5OH(密度为0.80 g·mL-1);36 mL 浓H2SO4(质量分数为98%,密度为1.84 g·mL-1);25 mL水。试回答下列问题:
(1)该实验应选择下图中的a装置还是b装置________。
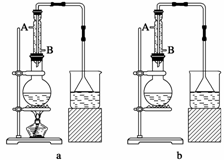
(2)反应装置中的烧瓶应选择下列哪种规格最合适( )
A.50 mL B.100 mL
C.150 mL D.250 mL
(3)冷凝管中的冷凝水的流向应是( )
A.A进B出 B.B进A出
C.从A进或B进均可
(4)实验完成后,须将烧瓶内的有机物蒸出,结果得到棕黄色的粗溴乙烷,欲得纯净溴乙烷,应采用的措施是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图中a为生铁,A烧杯中放入苯,B烧杯中为1 mol·L-1的稀硫酸,C烧杯中为海水。
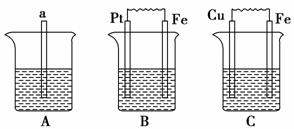
(1)B中Pt极的电极反应式为________。
(2)C中Cu极的电极反应式为________,Cu极附近溶液的pH________(填“增大”、“减小”或“不变”)。
(3)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是________。
(4)要使B中的铁难被腐蚀,可将B中的稀硫酸改为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,pH=3的盐酸a L分别与下列三种溶液充分混合后,溶液均呈中性:①c(NH3·H2O)=10-3 mol·L-1的氨水b L,②c(OH-)=10-3 mol·L-1的氨水c L,③c(OH-)=10-3 mol·L-1的Ba(OH)2溶液d L。试判断a、b、c、d的数量大小关系为( )
A.a=b>c>d B.b>a=d>c C.b>a>d>c D.c>a=d>b
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于电解质溶液中离子关系的说法正确的是( )
A.0.1 mol·L-1NaHCO3溶液中离子浓度关系:c(Na+)=2c(CO )+c(HCO
)+c(HCO )+c(H2CO3)
)+c(H2CO3)
B.0.1 mol·L-1 NH4Cl和0.1 mol·L-1 NH3·H2O等体积混合后离子浓度关系:c(Cl-)>c(NH )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
C.常温下,向醋酸钠溶液中滴加少量醋酸使溶液的pH=7,则混合溶液中:c(Na+)=c(CH3COO-)
D.常温下,在pH=1的溶液中,Fe2+、NO 、ClO-、Na+能大量共存
、ClO-、Na+能大量共存
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)BiCl3的水解产物中有BiOCl生成。
①写出BiCl3水解反应的方程式:
________________________________________________________________________。
②医药上将BiOCl称为次氯酸铋,该名称______(填“正确”或“不正确”)。
③如何配制BiCl3溶液?
(2)室温下,将pH=2的某酸HnA与pH=12的某碱B(OH)m等体积混合后溶液的pH=8。
①若生成的盐中只有一种离子水解,该离子水解的离子方程式为
________________________________________________________________________。
②简述该混合液呈碱性的原因。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com