
把在空气中久置的铝片5.0 g投入盛有500 mL 0.5 mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示,回答下列问题: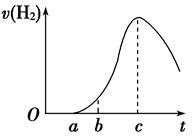
(1)曲线由O →a段不产生氢气的原因是___________________________________
有关反应的化学方程式为_________________________________
(2)曲线a→c段,产生氢气的速率增加较快的主要原因是_________________________
(3)曲线由c以后,产生氢气的速率逐渐下降的主要原因是_________________________
(4)该反应若使用催化剂,可使H2产量增多吗______________(填“会”或“不会”)。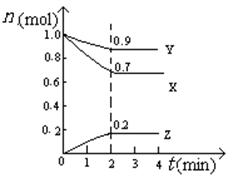
(5)某温度时,在2L密闭容器中X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。
由图中的数据分析,该反应的化学方程式为 。
反应从开始至2min末,Z的平均反应速率为 。
(12分)(1)硫酸首先和氧化铝反应,不产生H2(1分)
Al2O3+3H2SO4===Al2(SO4)3+3H2O(2分)
(2)反应放热,温度升高是影响反应速率的主要因素,使反应速率增大(2分)
(3)硫酸的浓度逐渐减小,该因素变为影响化学反应速率的主要因素,化学反应速率开始下降(2分)
(4)不会(1分)
(5)3X + Y 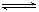 2Z (2分) 0.05mol/(L·min) (2分)
2Z (2分) 0.05mol/(L·min) (2分)
解析试题分析:(1)铝是活泼性较强的金属,能迅速和空气中的氧气反应生成氧化铝,氧化铝和稀硫酸反应生成氯化铝和水,所以离子方程式为Al2O3+6H+=2Al3++3H2O;
故答案为:硫酸首先与铝片表面的Al2O3反应; Al2O3+6H+=2Al3++3H2O;
(2)金属和酸的反应是放热反应,所以该反应放热,使溶液的温度升高,升高温度,化学反应速率加快.
故答案为:由于反应放出的热量使溶液温度升高而使反应速率加快了;
(3)随着反应的进行,溶液中的氢离子浓度逐渐降低,所以反应速率逐渐减小;
故答案为:随着反应的进行,硫酸溶液的浓度逐渐下降;
(4)催化剂不能使化学平衡移动,故H2产量不会增多。
(5)根据各个物质发生反应的物质的量之比等于其化学计量数之比,故化学方程式为3X + Y 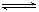 2Z。
2Z。
Z的平均反应速率为0.2mol÷2L÷2min= 0.05mol/(L·min)。
考点:化学反应速率变化曲线及其应用 化学反应速率的影响因素 化学反应速率的计算
点评:本题考查了根据图象分析外界条件对化学反应速率的影响、化学反应速率的计算等知识点,难度不大,易错的是(4)题,注意先进行过量计算,再根据不足量的物质为标准进行计算。


 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
 把在空气中久置的铝片5.0g投入盛有500mL0,5mol?L-1盐酸溶液的烧杯中该铝片与盐酸反应产生氢气的速率与反应时间可用如图所示的坐标曲线来表示,回答下列问题:
把在空气中久置的铝片5.0g投入盛有500mL0,5mol?L-1盐酸溶液的烧杯中该铝片与盐酸反应产生氢气的速率与反应时间可用如图所示的坐标曲线来表示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 (2011?鹰潭二模)把在空气中久置的铝片5.0g投入盛有 500mL 0.5mol?L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率v与反应时间t可用如图的坐标曲线来表示,下列推论错误的是( )
(2011?鹰潭二模)把在空气中久置的铝片5.0g投入盛有 500mL 0.5mol?L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率v与反应时间t可用如图的坐标曲线来表示,下列推论错误的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
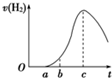 把在空气中久置的铝片5.0g投入盛有500mL 0.5mol?L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示.
把在空气中久置的铝片5.0g投入盛有500mL 0.5mol?L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示.查看答案和解析>>
科目:高中化学 来源: 题型:
把在空气中久置的铝片5.0 g投入盛有 500mL0.5 mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如右的坐标曲线来表示,回答下列问题:
(1)曲线由0→a段不产生氢气的原因___________,
有关反应的离子方程式为____________ ;
(2)曲线由a→b段产生氢气的速率较慢的原因___________
有关的化学方程式__________________________;
(3)曲线由b→c段,产生氢气的速率增加较快的主要原因_________________________;
(4)曲线由c以后,产生氢气的速率逐渐下降的主要原因_________________________。
查看答案和解析>>
科目:高中化学 来源:2014届山东省高一下学期期中考试化学试卷(解析版) 题型:填空题
(8分)把在空气中久置的铝片5.0 g投入盛有500 mL 0.5 mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示,回答下列问题:

(1)曲线由O →a段不产生氢气的原因是____________________________________________________________;
有关反应的化学方程式为
__________________________________________________;
(2)曲线a→c段,产生氢气的速率增加较快的主要原因是
________________________________________________________________________
________________________________________________________________________;
(3)曲线由c以后,产生氢气的速率逐渐下降的主要原因是_________________________;
(4)该反应若使用催化剂,可使H2产量增多吗?______(填“会”或“不会”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com