
下列物质含有离子键的是( )
|
| A. | Br2 | B. | CO2 | C. | NaBr | D. | H2O |
考点:
离子化合物的结构特征与性质.
专题:
化学键与晶体结构.
分析:
离子键:阴阳离子间通过静电作用形成的化学键,离子键往往在金属与非金属间形成.失去电子的往往是活泼金属元素的原子,而获得电子的往往是非金属元素的原子.通常,活泼金属与活泼非金属形成离子键.
解答:
解:A.Br2中存在的是Br﹣Br共价键,故A错误;
B.CO2中存在的C=O共价键,故B错误;
C.NaBr是由钠离子和溴离子通过离子键结合成的离子化合物,故C正确;
D.H2O含有的是H﹣O共价键,故D错误;
故选C.
点评:
本题考查了离子键的判断,判断离子键、共价键应注意二者成键微粒和成键条件的不同.


科目:高中化学 来源: 题型:
在银锌原电池中,以硫酸铜为电解质溶液,锌为极,电极上发生的是反应(“氧化”或“还原”),电极反应式为,锌片上观察到的现象为.银为正极,电极上发生的是反应(“氧化”或“还原”),电极反应式是,银片上观察到的现象是.
查看答案和解析>>
科目:高中化学 来源: 题型:
反应A+3B═2C+2D在四种不同的情况下的反应速率如下,最快的是()
A. v(A)=0.15mol/(L•min) B. v(B)=0.6mol/(L•min)
C. v(c)=0.4mol/(L•min) D. v(D)=0.45mol/(L•min)
查看答案和解析>>
科目:高中化学 来源: 题型:
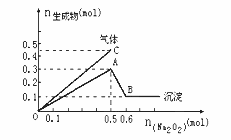
向一定量的Mg2+、NH4+、Al3+混合溶液中加入Na2O2的量与生成沉淀和气体的量(纵坐标)的关系如图所示,则溶液中Mg2+、NH4+、Al3+三种离子的物质的量之比为( )。
A. 1∶1∶2
B. 2∶2∶1
C. 1∶2∶2
D.9∶2∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
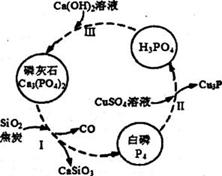
氮、磷及其化合物在科研及生产中均有着重要的应用。
(1)1个NH4+的电子数为_______个,沸点PH3_______NH3(填大于、小于或等于)。
(2)NaNO2有毒,与食醋共熟会生成两种中学常见的氮氧化物气体,该反应的离子方程式为__________________________________________
(3)磷及部分重要化合物的相互转化关系如下图所示。
①白磷(P4)的晶体类型为____________________。
②步骤I是白磷(P4)的工业生产方法。反应在高温条件下进行,其中SiO2的作用是用于造渣
(CaSiO3),焦炭的作用是作______________。 (填氧化剂或还原剂)
③不慎将自磷(P4)沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol CuSO4
所能氧化的自磷(P4)的物质的量为___________
(4)人的牙齿表面有一层釉质,其组成为羟基磷灰石 Ca5(PO4)3OH(ksp=6.8×10﹣37)。人们常使用舍氟离子的牙膏防蛀牙,其中的氟化物可使羟基磷灰石转化为氟磷灰石Ca5(PO4)3F(Ksp=1.0×10﹣60)。写出该反应的离子方程式_____________________,该反应的平衡常数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
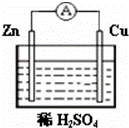
对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法不正确的是( )
|
| A. | Zn是负极 | B. | Cu是正极 |
|
| C. | 负极上发生氧化反应 | D. | 正极上发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
相同物质的量浓度的NaCN和NaClO溶液相比,前者的pH较大,则下列有关同温、同体积和同浓度的HCN和HClO叙述中,正确的是( )
|
| A. | 酸性:HCN>HClO |
|
| B. | pH:HClO>HCN |
|
| C. | 浓度:c(CN﹣)<c(ClO﹣) |
|
| D. | 与NaOH恰好完全反应时,消耗NaOH的物质的量:HClO>HCN |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com