
某工厂排出的废液中含有Ba2+、Ag+、Cu2+,用①Na2SO4溶液,②NaOH溶液,③盐酸三种试剂将它们逐一沉淀并加以分离,加入试剂的正确顺序是( )
A.②③① B.②①③ C.①②③ D.③①②
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源:2017届河北省等五校高三上学期第一次模拟化学试卷(解析版) 题型:选择题
在密闭容器中,反应2X(g)+ Y2(g) 2XY(g) △H<0,达到甲平衡。在仅改
2XY(g) △H<0,达到甲平衡。在仅改
变某一条件后,达到乙平衡,下列分析正确的是
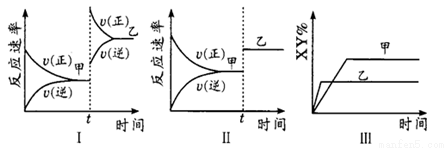
A.图I中,甲、乙的平衡常数分别为K1、K2,则K1<K2
B.图Ⅱ中,平衡状态甲与乙相比,平衡状态甲的反应物转化率低
C.图Ⅱ中,t时间是增大了压强
D.图Ⅲ是反应分别在甲、乙条件下达到平衡,说明乙温度高于甲
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上学期第一次月考化学试卷(解析版) 题型:选择题
下列说法或表示方法正确的是( )
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.在稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓硫酸与含1mol NaOH的溶液混3/(5×30)mol/(L·s)=合,放出的热量大于57.3 kJ
C.由C(石墨) ===C(金刚石) ΔH=1.90 kJ·mol-1可知,金刚石比石墨稳定
D.在100 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则H2燃烧的热化学方程式为2H2(g)+O2(g)===2H2O(l) ΔH=-285.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高一上学期第一次月考化学试卷(解析版) 题型:选择题
用10mL 0.1mol/L的BaCl2溶液分别和相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液反应,均恰好使三份溶液中的SO42-离子完全转化为BaSO4沉淀,则三种硫酸盐溶液的物质的量浓度之比是( )
A.3∶2∶2 B.1∶2∶3 C. 3∶1∶1 D.1∶3∶3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高一上学期第一次月考化学试卷(解析版) 题型:选择题
有98g纯H2SO4和纯H3PO4的混酸,测知其中含氧元素65.3%,则混酸中H2SO4和H3PO4的物质的量之比为( )
A.1:1 B.3:1 C.4:1 D.任意比
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高二上学期第一次月考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列叙述中不正确的是( )
①12.4g白磷晶体中含有的P﹣P键数约是0.6NA;
②电解精炼铜时转移了NA个电子,阳极溶解32g铜;
③7.8g Na2S和Na2O2的混合物中含有的阴离子数大于0.1NA;
④2mol SO2和1mol O2混合在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2NA;
⑤2.9g 2CaSO4•H2O含有的结晶水分子数为0.02NA (2CaSO4•H2O式量为290);
⑥1molFeCl3与沸水反应生成胶体后,含有NA个Fe(OH)3胶粒;
⑦含0.1mol溶质Na2CO3的溶液中,所含阴离子总数大于0.1NA.
A.①②③④⑤⑦ B.②③⑤⑥ C.①③④⑤⑥ D.③④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源:2017届广东省高三上学期第一次月考化学试卷(解析版) 题型:填空题
恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示。
已知:2SO2(g)+O2(g)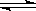 2SO3(g) ΔH=-196.6 kJ/mol。
2SO3(g) ΔH=-196.6 kJ/mol。
请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式: 。
(2)状态II到状态III放出的热量为 。
(3)恒温恒容时,1 mol SO2和2 mol O2充分反应,放出热量的数值比∣ΔH2∣ (填“大”、“小”或“相等”)。
(4)将Ⅲ中的混合气体通入足量的NaOH溶液中消耗NaOH的物质的量为 ,若溶液中发生了氧化还原反应,则该过程的离子方程式为: 。
(5)恒容条件下,下列措施中能使n(SO3)/ n(SO2)增大的有 。
A.升高温度
B.充入He气
C.再充入1 mol SO2(g)和1 mol O2(g)
D.使用催化剂
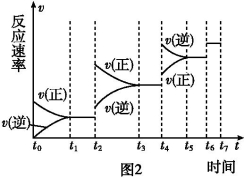
(6)某SO2(g)和O2 (g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中SO3的含量最高的一段时间是 。
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上学期开学考试化学试卷(解析版) 题型:选择题
下列说法正确的是(NA为阿伏加德罗常数)
A.在1mol甲基(—CH3)中,电子总数9NA
B.在1mol的Na2O2中,有2NA个阴离子
C.标准状况下,22.4L CHC13所含有的分子数目为NA
D.Cu、A1为电极,浓硝酸为电解质溶液所构成的原电池中,导线上流过NA个电子,则A1电极放出气体的体积一定为22.4L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com