
【题目】短周期元素X、Y、Z、W的原子序数依次增大。用表中信息判断下列说法正确的是
元素 | X | Y | Z | W |
最高价氧化物的水化物 | H3ZO4 | |||
| 1.00 | 13.00 | 1.57 | 0.70 |
A.元素电负性:Z<WB.简单离子半径:W<Y
C.元素第一电离能:Z<WD.简单氢化物的沸点:X<Z
【答案】A
【解析】
四种短周期元素,均可以形成最高价氧化物对应的水化物。有H3ZO4可知,该酸为弱酸,则Z为P元素;0.1 molL1 W的最高价氧化物对应的水化物的pH为0.70,说明该物质为多元强酸,为硫酸,则W为S元素;0.1 molL1 Y的最高价氧化物对应的水化物的pH为13.00,说明该物质为一元强碱,为氢氧化钠,则Y为Na元素;0.1 molL1 X的最高价氧化物对应的水化物的pH为1.00,说明该物质为一元强酸,为硝酸,则Y为N元素,据此回答。
A.同一周期元素的电负性随着原子序数的递增而增大,因S的原子序数大于P,则S的电负性大于P,胡A正确;
B.电子层数越多离子半径越大,Na+有两个电子层而S2有三个电子层,因此S2的离子半径较大,故B错误;
C.同一周期元素原子的第一电离能总趋势为依次增大,但由于第ⅡA、ⅤA族元素的电子排布结构为全充满或半充满状态,原子结构较为稳定,故第ⅡA、ⅤA族元素的第一电离能较相邻两个主族的电离能较大,故P的第一电离能大于S,故C错误;
D.相对分子质量越大,物质的熔沸点越高,但由于X的氢化物NH3中含有分子间氢键,因此NH3的沸点高于PH3的沸点,故D错误;
综上所述,答案为A。


科目:高中化学 来源: 题型:
【题目】(某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
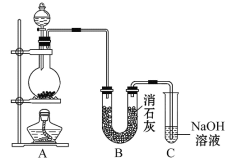
(1)在A装置中用固体二氧化锰与浓盐酸在加热条件下制取氯气,反应原理为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,请在该反应方程式中标出电子转移方向和数目________,并指出氧化剂为___________,还原剂为________。
MnCl2+Cl2↑+2H2O,请在该反应方程式中标出电子转移方向和数目________,并指出氧化剂为___________,还原剂为________。
(2)漂白粉将在U形管中产生,其化学方程式是________________________________。
(3)C装置的作用是___________________。
(4)此实验所得漂白粉的有效成分偏低。该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应:
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可将采取的措施是_________________________________________。
②试判断另一个副反应(用化学方程式表示)___________________________________________;为避免此副反应的发生,可将装置作何改进____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室分离Fe3+和Al3+的流程如下:
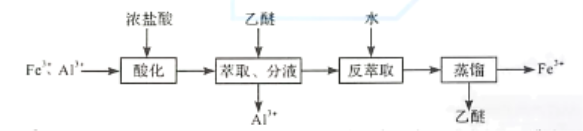
知Fe3+在浓盐酸中生成黄色配离子(FeCl4),该配离子在乙醚(Et2O,沸点34.6℃)中生成缔合物![]() 。下列说法错误的是
。下列说法错误的是
A.萃取振荡时,分液漏斗下口应倾斜向下
B.分液时,应先将下层液体由分液漏斗下口放出
C.分液后水相为无色,说明已达到分离目的
D.蒸馏时选用直形冷凝管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于1mol/L的氨水,下列叙述正确的是(忽略溶液混合时的体积变化)( )
A.将标准状况下22.4L氨气溶于1 L水配成溶液,即可得到1mol/L的氨水
B.1mol/L的氨水的质量分数小于1.7%
C.1mol/L的氨水与水等质量混合后,所得氨水的物质的量浓度大于0.5mol/L
D.将1mol/L的氨水与3mol/L的氨水等质量混合后,所得氨水的物质的量浓度为2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能路灯蓄电池是磷酸铁锂电池,其工作原理如图。M电极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜为阳离子交换膜,电池反应式为LixC6+Li1-xFePO4![]() LiFePO4+6C。下列说法正确的是( )
LiFePO4+6C。下列说法正确的是( )
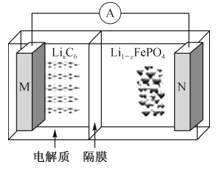
A.放电时Li+从左边移向右边,PO43-从右边移向左边
B.放电时,正极反应式为Li1-xFePO4+xLi++xe-=LiFePO4
C.充电时M极连接电源的负极,电极反应为6C+xe-=C6x-
D.紧急情况时,电解质可以用Li2SO4饱和溶液代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生对SO2与漂粉精的反应进行实验探究:
操作 | 现象 |
取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
| i.液面上方出现白雾; ii.稍后,出现浑浊,溶液变为黄绿色; iii.稍后,产生大量白色沉淀,黄绿色褪去 |
(1)Cl2和Ca(OH)2制取漂粉精的化学方程式是___。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是___。
(3)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成,进行如下实验:
A.用湿润的碘化钾淀粉试纸检验白雾,无变化;
B.用硝酸酸化的AgNO3溶液检验白雾,产生白色沉淀。
①实验A目的是___。
②由实验A、B不能判断白雾中含有HC1,理由是___。
(4)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和C1-发生反应。通过进一步实验确认了这种可能性,其实验方案是___。
(5)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HC1,无明显变化。取上层清液,加入BaC12溶液,产生白色沉淀。则沉淀X中含有的物质是__。
②用离子方程式解释现象iii中黄绿色褪去的原因:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据原子结构、元素周期表和元素周期律的知识回答下列问题:
(1)A元素次外层电子数是最外层电子数的![]() ,其外围电子排布图是__________。
,其外围电子排布图是__________。
(2)B是1~36号元素原子核外电子排布中未成对电子数最多的元素,B元素的名称是____,价层电子排布式_________,在元素周期表中的位置是____________。
(3)C元素基态原子的电子排布图是下图中的____(填序号),另一个不能作为基态原子的电子排布图因为它不符合__(填序号)。
①
②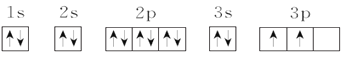
A.能量最低原理 B.泡利原理 C.洪特规则
(4)第三周期元素的气态电中性基态原子失去最外层一个电子转化为气态基态正离子所需的最低能量叫作第一电离能(设为E)。如图所示:
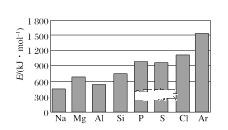
①同周期内,随着原子序数的增大,E值变化的总趋势是____;
②根据图中提供的信息,可推断出E氧____E氟(填“>”“<”或“=”,下同);
③根据第一电离能的含义和元素周期律,可推断出E镁___E钙。
(5)判断BCl3分子的空间构型、中心原子成键时采取的杂化轨道类型及分子中共价键的键角:________、___________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)在地壳中含量不大,但砷的化合物却丰富多彩。
(1)基态砷原子的电子排布式为________;砷与溴的第一电离能较大的是____________。
(2)AsH3是无色稍有大蒜味的气体。AsH3的沸点高于PH3,其主要原因是________________________________________________________________。
(3)Na3AsO4可作杀虫剂。AsO43-的空间构型为________,与其互为等电子体的一种分子为________。
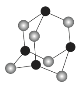
(4)某砷的氧化物俗称“砒霜”,其分子结构如图所示。该化合物的分子式为____________,As原子采取________杂化。
(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似,GaAs晶体中,As与Ga之间存在的化学键有________(填字母)。
A.离子键 B.σ键 C.π键 D.氢键 E.配位键 F.金属键 G.极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】强酸性溶液X中可能含有Na+、K+、NH4+、Fe2+、A13+、CO32-、SO32-、SO42-、C1-中的若干种,某同学为了确认其成分,取X溶液进行连续实验,实验过程及产物如下:

下列结论正确的是
A. X中肯定存在Na+、Fe2+、A13+、NH4+、SO42-
B. 气体F经催化氧化可直接生成气体D
C. 沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3 、沉淀I一定是Al(OH )3
D. X中不能确定的离子是 A13+、Na+、K+和C1-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com