
| A、肯定有A13+、Mg2+、Cl- |
| B、肯定有A13+、Mg2+、NH4+ |
| C、肯定有K+、HCO3-、MnO4- |
| D、肯定有A13+、Mg2+、SO42- |


科目:高中化学 来源: 题型:
| A、生成的氢气中只含有D2 |
| B、生成的氢气中只含有H2 |
| C、生成的氢气中含有H2、HD、D2 |
| D、以上判断都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
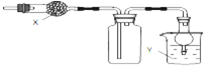
| A、X是碱石灰,收集到的气体是氯化氢,Y是水 |
| B、X是碱石灰,收集到的气体是氨气,Y是水 |
| C、X是氯化钙,搜集到的气体是二氧化硫,Y是氢氧化钠 |
| D、X是氯化钙,收集到的气体是一氧化氮,Y是氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O是白色固体,Na2O2是淡黄色固体 |
| B、两物质都是碱性氧化物,其中氧元素的化合价都是-2价 |
| C、两者都能和水、二氧化碳、盐酸发生反应 |
| D、Na2O2比Na2O稳定,Na2O在一定条件下可转化为Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | Z | |
| ① | NaOH溶液 | SiO2 | 氢氟酸 |
| ② | O2 | N2 | H2 |
| ③ | 双氧水 | SO2 | BaCl2溶液 |
| ④ | FeCl3溶液 | Cu | 浓硝酸 |
| A、①③ | B、①④ | C、②④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
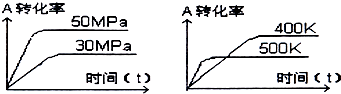 如图表示可逆反应mA(g)+nB(s)?xC(g)在不同温度和压强下,反应物A的转化率变化情况.下列判断正确的是( )
如图表示可逆反应mA(g)+nB(s)?xC(g)在不同温度和压强下,反应物A的转化率变化情况.下列判断正确的是( )| A、m>x,正反应为放热反应 |
| B、m+n<x,正反应为吸热反应 |
| C、m<x,正反应为放热反应 |
| D、m>x,正反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuO |
| B、Fe3O4 |
| C、Al2O3 |
| D、PbO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com