
下列实验操作中错误的是
A.提取碘水中的碘单质时,应选择有机萃取剂,且萃取剂与水不互溶
B.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.蒸馏操作时,冷凝水方向应当由下往上
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015届黑龙江省哈尔滨市高三上学期期中考试化学试卷(解析版) 题型:选择题
浓硫酸有许多重要的性质,在与含有水分的蔗糖作用过程中不能显示的性质是
A.酸性 B.脱水性 C.强氧化性 D.吸水性
查看答案和解析>>
科目:高中化学 来源:2015届黑龙江省高一上学期期中考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.水导电性很差,所以水是非电解质
B.电解质与非电解质的本质区别是在一定条件下能否电离
C.酸、碱和盐类都属于电解质,其他化合物都是非电解质
D.NaCl和HCl都是电解质,所以它们熔融状态下都能导电
查看答案和解析>>
科目:高中化学 来源:2015届黑龙江省双鸭山市高一上学期期中考试化学试卷(解析版) 题型:填空题
(18分)(1)若NA为阿伏伽德罗常数,则3.4g氨气中所含氢原子个数为 。
(2)约3.01×1023个OH-的质量为 g,含有电子的物质的量为 ,这些OH-与 mol NH3的质量相同。
(3)将4gNaOH固体溶于水配成250mL溶液,此溶液中NaOH的物质的量浓度为 __mol/L。取出10mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为_____________mol/L。
(4)现有M、N两种气态化合物,其摩尔质量之比为2:1,试回答下列问题:
①同温同压下,M、N气体的密度之比为____________
②相同温度下,在两个相同体积的密闭容器中分别充入M、N,若两个容器中气体的密度相等,则两个容器中的压强之比为____________
③将M、N两种气体分别溶于水(M、N与水均不反应)配成溶液,当两种溶液的质量分数相同时,其密度分别为d1和d2,则两种溶液的物质的量浓度之比为____________。
查看答案和解析>>
科目:高中化学 来源:2015届黑龙江省双鸭山市高一上学期期中考试化学试卷(解析版) 题型:选择题
人体中正常的的血红蛋白中含有Fe2+,若误食亚硝酸盐,则导致血红蛋白中的Fe2+转化高铁(Fe3+)血红蛋白而中毒,服用维生素C可解除亚硝酸盐中毒。下列叙述中正确的是
A.亚硝酸盐是还原剂 B.维生素C发生还原反应
C.维C将Fe3+转化成Fe2+ D.亚硝酸盐被氧化
查看答案和解析>>
科目:高中化学 来源:2015届黑龙江省双鸭山市高一上学期期中考试化学试卷(解析版) 题型:选择题
下列有关胶体的说法正确的是
A.胶体一定是混合物
B.胶体与溶液的本质区别是有丁达尔效应
C.将饱和氯化铁溶液滴入稀氢氧化钠溶液中加热,可得氢氧化铁胶体
D.胶体能通过半透膜
查看答案和解析>>
科目:高中化学 来源:2015届陕西省宝鸡市岐山县高三上学期期中考试化学试卷(解析版) 题型:实验题
(10分)某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质。
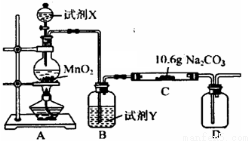
(1)装置A中发生反应的离子方程式为_____________________________________
(2)装置B中试剂Y应为________________________________________
(3)已知在装置C中通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体(含氯氧化物),C中含氯元素的物质是一种盐,且含有NaHCO3。现对C中的成分进行猜想和探究:
①提出合理假设
假设一:存在两种成分,为NaHCO3、____________
假设二:存在三种成分,为NaHCO3、_________________________________
②设计方案并实验。请在表格中写出实验步骤以及预期现象和结论。
限选试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
实验步骤 | 预期现象和结论 |
步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水,然后将所得溶液分别置于A、B试管中。 | 固体物质全部完全溶解 |
步骤2:向A试管中滴加适量BaCl2溶液。 | 如果 如果_______________________ |
步骤3: | 有白色沉淀生成,C的成分有NaCl |
结论:由步骤3的结论结合步骤2中的a,则假设一成立;由步骤3的结论结合步骤2中的b,则假
设二成立。
(4)该实验装置明显存在不足之处,改进的措施为__________________________________________
(5)若C中有0.1molCl2参加反应,且假设一成立,由此可推知C中反应生成的含氯氧化物为
(写化学式)。
查看答案和解析>>
科目:高中化学 来源:2015届重庆市高三上期第一次月考理综化学试卷(解析版) 题型:填空题
(共13分)氯碱工业是最基本的化学工业之一,其主要原理基于电解饱和食盐水:2NaCl+2H2O 2NaOH+H2↑+Cl2↑,它的产品烧碱和氯气以及氢气应用广泛。请回答下列问题:
2NaOH+H2↑+Cl2↑,它的产品烧碱和氯气以及氢气应用广泛。请回答下列问题:
(1)电解前,如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42- ,该钡试剂可以是______________(填字母代号)。
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
(2)“盐泥”是电解食盐水过程中形成的工业“废料”。某工厂的盐泥组成如下:
成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | 其他不溶物 |
质量分数(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |
利用盐泥生产MgSO4·7H2O晶体的工艺流程如下图所示。

回答下列问题:
①酸洗过程中加入适量硫酸控制pH为5左右,反应温度在50℃左右。持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,CaCO3在此过程中转化为CaSO4,请解释此转化得以发生的原因_________。
②过滤所得滤渣的主要成分为____________________________。
③根据下图分析,蒸发结晶过滤所得晶体A主要成分为____________________。

④真空干燥MgSO4·7H2O晶体的原因是______________________。
(3)已知NaCl在60 ℃的溶解度为37.1 g,现电解60 ℃精制饱和食盐水1371 g,经分析,电解后溶液密度为1.37 g·cm-3,其中含有20 g NaCl,则电解后NaOH的物质的量浓度为________________mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com