
| A. | 常温常压下,44g丙烷含有共价键的数目为10NA | |
| B. | 1 L 1 mol•L-1的Na2CO3溶液中含有氧原子的数目为3NA | |
| C. | 常温常压下,11.2L由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 标准状况下,6.72 L NO2溶于足量的水中,转移电子的数目为0.3NA |
分析 A、求出丙烷的物质的量,然后根据丙烷中含10条共价键来分析;
B、在碳酸钠溶液中,除了碳酸钠外,水也含氧原子;
C、常温常压下,气体摩尔体积大于22.4L/mol;
D、求出二氧化氮的物质的量,然后根据二氧化氮和水的反应中,3mol二氧化氮转移2mol电子来分析.
解答 解:A、44g丙烷的物质的量为1mol,而丙烷中含10条共价键,故1mol丙烷中含10NA条共价键,故A正确;
B、在碳酸钠溶液中,除了碳酸钠外,水也含氧原子,故溶液中的氧原子的个数大于3NA个,故B错误;
C、常温常压下,气体摩尔体积大于22.4L/mol,故11.2L混合气体的物质的量小于0.5mol,则含有的原子个数小于NA个,故C错误;
D、标况下6.72L二氧化氮的物质的量为0.3mol,而二氧化氮和水的反应中,3mol二氧化氮转移2mol电子,故0.3mol二氧化氮转移0.2NA个电子,故D错误、.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


科目:高中化学 来源: 题型:多选题
| A. | 向浓度为0.1mol•L-1的NaHCO3溶液中滴加少量盐酸后所得溶液中:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合所得溶液中:c(CH3COO-)+c(H+)>c(Na+)+c(OH-) | |
| C. | 0.1 mol•L-1CH3COOH溶液和0.1 mol•L-1CH3COONa溶液等体积混合:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 0.1 mol•L-1 NH4HSO4溶液中滴加0.1 mol•L-1 NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 物质 | 杂质 | 试剂或用品 | 主要操作 | |
| A | 淀粉 | 碘化钾 | 半透膜 | 渗析 |
| B | Fe(NO3)2 | Ba(NO3)2 | 硫酸 | 过滤 |
| C | Fe | I2 | / | 加热 |
| D | 溴 | 四氧化碳 | 蒸馏装置 | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
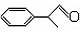 )曾入选伦敦奥运会指定产品,下面是工业合成龙葵醛的路线图(部分反应条件及副产物已略去),回答问题:
)曾入选伦敦奥运会指定产品,下面是工业合成龙葵醛的路线图(部分反应条件及副产物已略去),回答问题: $→_{催化剂}^{CH_{3}CH=CH_{2}}$$\stackrel{A}{{C}_{9}{H}_{12}}$$→_{光照}^{Cl_{2}}$$\stackrel{B}{{C}_{9}{H}_{11}{C}_{1}}$→${\stackrel{C}{{C}_{9}{H}_{10}}}_{\;}$$\stackrel{HBr}{→}$$\stackrel{D}{{C}_{9}{H}_{11}Br}$→$\stackrel{E}{{C}_{9}{H}_{12}O}$$→_{△}^{催化剂}$龙葵醛
$→_{催化剂}^{CH_{3}CH=CH_{2}}$$\stackrel{A}{{C}_{9}{H}_{12}}$$→_{光照}^{Cl_{2}}$$\stackrel{B}{{C}_{9}{H}_{11}{C}_{1}}$→${\stackrel{C}{{C}_{9}{H}_{10}}}_{\;}$$\stackrel{HBr}{→}$$\stackrel{D}{{C}_{9}{H}_{11}Br}$→$\stackrel{E}{{C}_{9}{H}_{12}O}$$→_{△}^{催化剂}$龙葵醛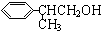 +O2
+O2
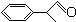 +2H2O.
+2H2O. 或
或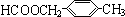 (任写一种).
(任写一种).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
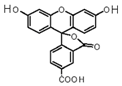 2008年诺贝尔化学奖授予美籍华裔钱永健等三位科学家,以表彰他们发现和研究了绿色荧光蛋白.荧光素是发光物质的基质,5-羧基荧光素(5-FAM)结构简式如图所示,在碱性条件下有强烈的绿色荧光,广泛应用于荧光分析等.下列有关5-FAM说法不正确的是( )
2008年诺贝尔化学奖授予美籍华裔钱永健等三位科学家,以表彰他们发现和研究了绿色荧光蛋白.荧光素是发光物质的基质,5-羧基荧光素(5-FAM)结构简式如图所示,在碱性条件下有强烈的绿色荧光,广泛应用于荧光分析等.下列有关5-FAM说法不正确的是( )| A. | 可与碳酸氢钠溶液反应 | |
| B. | 分子式为C21H12O7 | |
| C. | 1mol 该物质与足量NaOH溶液反应,可消耗4 mol氢氧化钠 | |
| D. | 不与FeCl3发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com