
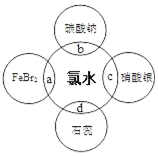
分析 (1)氯气为有毒的气体;
(2)工业上将氯气通入石灰乳制取漂白粉,生成Ca(ClO)2、CaCl2;
(3)漂白粉的主要成分为Ca(ClO)2、CaCl2,有效成分是Ca(ClO)2;
(4)①依据配制一定物质的量浓度溶液的一般步骤选择需要仪器;
②分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
③n(KI)=0.06mol,与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则n(I2)=n(KIO3)=0.02mol,结合化合价的变化计算转移的电子的数目,可计算消耗KMnO4的物质的量;
(5)将氯气溶于水得到氯水(浅黄绿色),氯水含多种微粒,其中有H2O、Cl2、HClO、Cl-、H+、OH-(极少量,水微弱电离出来的).
解答 解:(1)氯气为有毒的气体,则①中钢瓶上应贴的标签为C,不易燃、易爆,本身不具有腐蚀性,
故答案为:C;
(2)工业上将氯气通入石灰乳制取漂白粉,生成Ca(ClO)2、CaCl2,所以化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(3)漂白粉的主要成分为Ca(ClO)2、CaCl2,有效成分是Ca(ClO)2,
故答案为:Ca(ClO)2;
(4)①配制500mL 0.1mol/L的KMnO4溶液溶液的步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,用到的仪器:天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、500ml容量瓶,所以还缺失的仪器:500ml的容量瓶,故答案为:500ml容量瓶;
②a.转移时没有洗涤烧杯、玻璃棒,导致溶质的物质的量减小,所以偏小,故正确;
b.容量瓶内壁附有水珠而未干燥处理,不影响,故错误;
c.颠倒摇匀后发现凹液面低于刻度线又加水补上,体积变大,浓度偏小,故正确;
d.加水定容时俯视刻度线,体积偏小,浓度变大,故错误;
故选:a、c,
故答案为:ac;
③n(KI)=0.06mol,与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则n(I2)=n(KIO3)=0.02mol,共失去电子的物质的量为2×0.02mol+0.02mol×[5-(-1)]=0.16mol,则消耗KMnO4的物质的量的是$\frac{0.16mol}{7-2}$=0.032mol,所以消耗KMnO4的体积为320mL,
故答案为:320;
(5)①能证明氯水具有漂白性的是石蕊先变红后褪色,
故答案为:d;溶液先变红后褪色;
②Cl2是新制氯水的主要成分,具有强氧化性,与KBr发生氧化还原反应:3Cl2+2Fe 2++4Br-=6Cl-+2Fe 3++2Br2;
故答案为:3Cl2+2Fe 2++4Br-=6Cl-+2Fe 3++2Br2.
点评 本题考查据氯气的化学性质,学生要把握氯气的性质、氯水的成分及物质性质与用途的关系等为解答的关键,侧重分析、应用及计算能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 2.4 g金属镁变为镁离子时失去的电子数为0.1NA | |
| B. | 常温常压下,22.4L CO2和SO2混合气体含有2NA个O原子 | |
| C. | 22.4 L CH4与18 g H2O所含有质子数均为10NA | |
| D. | 常温常压下,80g SO3含有的氧原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-甲基丙烷(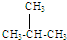 )也叫异丁烷 )也叫异丁烷 | |
| B. | 蛋白质和糖类均为天然高分子化合物 | |
| C. | 乙烯和丙烯只能发生加成反应,不能发生取代反应 | |
| D. | 苯使溴水褪色的原因是发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2(SO4)3=2Al3++3SO42- | B. | NaHCO3=Na++H++CO32- | ||
| C. | Ba(OH)2=Ba2++2 OH- | D. | Na2CO3=2Na++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 精炼铜过程中阴极增重6.4 g时,电路中转移电子数大于0.2NA | |
| B. | 标准状况下,11.2 L氨气溶于水配制成500 mL溶液,溶液中NH4+数目为0.5NA | |
| C. | 1 mol D318O+中含有的中子数为10NA | |
| D. | 7.8 g Na2S和Na2O2的混合物中含有的阴离子总数等于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铁罐储存浓硝酸 | |
| B. | 用MgO、Al2O3制作耐高温坩埚 | |
| C. | 用铁芯铝绞线作为高压输电线材料 | |
| D. | 用钠钾合金作为快中子反应堆的热交换剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
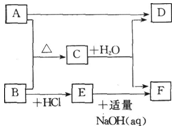 A、B、C、D、E、F是中学化学中的常见物质,它们之间的转化关系如图所示.其中 A、B为单质,F为白色沉淀,D为气体.
A、B、C、D、E、F是中学化学中的常见物质,它们之间的转化关系如图所示.其中 A、B为单质,F为白色沉淀,D为气体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用石墨电极电解Ca(NO3)2溶液,当转移电子数为0.2 NA时,阴极析出4 g金属 | |
| B. | 0.1 mol24Mg32S晶体中所含中子总数为2.8 NA | |
| C. | 常温下含有NA个NO2、N2O4分子的混合气体,温度降至标准状况,其体积约为22.4 L | |
| D. | 在熔融状态下,1 mol NaHSO4完全电离出的阳离子数目为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液 c(Na+ )与 c(CO3)之比为 2:1 | |
| B. | pH=2 和 pH=1 的硝酸中 c(H+)之比为 1:2 | |
| C. | 0.2mol/L 与 0.1mol/L 醋酸中 c(H+)之比为 2:1 | |
| D. | pH=1 的硫酸中加入等体积 0.1mol/L 的 NaOH 溶液,两者恰好完全反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com