
有硫酸亚铁、硫酸铜混合溶液300mL,其中硫酸根离子浓度为0.1mol/L,投入一些锌粉,反应后得到一些固体沉淀,经测定,沉淀含有铜、铁,不含有锌粉。溶液中还有0.01mol
![]() ,据此可知投入的锌粉质量为
,据此可知投入的锌粉质量为
[ ]
![]()
科目:高中化学 来源: 题型:
(2011?宝鸡一模)下表中实验操作能达到实验目的或得出正确结论的是( )
|
查看答案和解析>>
科目:高中化学 来源: 题型:
过氧化氢(H2O2)有广泛的用途,过氧化氢的沸点为150℃。工业上用电解硫酸氢铵水溶液的方法制备过氧化氢,其反应原理是:2NH4HSO4 (NH4)S2O8+H2↑,(NH4)2S2O8+2H2O=2NH4HSO4+H2O2。其流程如下:
(NH4)S2O8+H2↑,(NH4)2S2O8+2H2O=2NH4HSO4+H2O2。其流程如下:
请回答下列问题:
(NH4)2S2O8中硫元素的化合价为_______。
(2)过氧化氢具有的化学性质是______。(填字母)。
A.不稳定性 B.弱碱性 C.氧化性 D.还原性
(3)根据以上反应原理可知,电解硫酸氢铵溶液时,阳极的电极反应方程式是:
_______________________________________
(4)在上面流程图中,采用减压蒸馏的原因是:____________________________.
可循环利用的物质是_____________。
(5)硫酸铜酸性溶液中混有少量硫酸亚铁,为除去杂质,用过氧化氢把硫酸亚铁氧化,反应的离子方程式是________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2011届重庆市南开中学高三最后一次模拟考试(理综)化学部分 题型:填空题
过氧化氢(H2O2)有广泛的用途,过氧化氢的沸点为150℃。工业上用电解硫酸氢铵水溶液的方法制备过氧化氢,其反应原理是:2NH4HSO4 (NH4)S2O8+H2↑,(NH4)2S2O8+2H2O=2NH4HSO4+H2O2。其流程如下:
(NH4)S2O8+H2↑,(NH4)2S2O8+2H2O=2NH4HSO4+H2O2。其流程如下: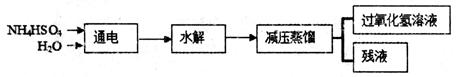
请回答下列问题:
(NH4)2S2O8中硫元素的化合价为_______。
(2)过氧化氢具有的化学性质是______。(填字母)。
| A.不稳定性 | B.弱碱性 | C.氧化性 | D.还原性 |
查看答案和解析>>
科目:高中化学 来源:2013届广东省汕头市潮阳一中高三上学期第一次月考理综化学试卷(带解析) 题型:填空题
(16分)过氧化氢(H2O2)有广泛的用途。工业上用电解硫酸氢铵水溶液的方法制备过氧化氢,其反应原理是:2NH4HSO4 (NH4)2S2O8+H2↑,
(NH4)2S2O8+H2↑,
(NH4)2S2O8+2H2O==2NH4HSO4 + H2O2。其流程如下: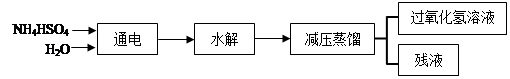
回答下列问题:
(1)根据以上反应原理可知,电解硫酸氢铵溶液时,阴极的电极反应方程式是:
。
(2)在上流程图中,采用减压蒸馏的原因是: 。
可循环利用的物质是 。
(3)过氧化氢具有的化学性质是 。
| A.不稳定性 | B.弱碱性 | C.氧化性 | D.还原性 |
查看答案和解析>>
科目:高中化学 来源:2010-2011学年重庆市高三最后一次模拟考试(理综)化学部分 题型:填空题
过氧化氢(H2O2)有广泛的用途,过氧化氢的沸点为150℃。工业上用电解硫酸氢铵水溶液的方法制备过氧化氢,其反应原理是:2NH4HSO4 (NH4)S2O8+H2↑,(NH4)2S2O8+2H2O=2NH4HSO4+H2O2。其流程如下:
(NH4)S2O8+H2↑,(NH4)2S2O8+2H2O=2NH4HSO4+H2O2。其流程如下:
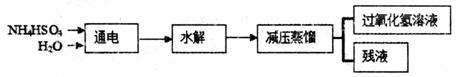
请回答下列问题:
(NH4)2S2O8中硫元素的化合价为_______。
(2)过氧化氢具有的化学性质是______。(填字母)。
A.不稳定性 B.弱碱性 C.氧化性 D.还原性
(3)根据以上反应原理可知,电解硫酸氢铵溶液时,阳极的电极反应方程式是:
_______________________________________
(4)在上面流程图中,采用减压蒸馏的原因是:____________________________.
可循环利用的物质是_____________。
(5)硫酸铜酸性溶液中混有少量硫酸亚铁,为除去杂质,用过氧化氢把硫酸亚铁氧化,反应的离子方程式是________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com